Курсовая работа: Обеспечение экологической безопасности путем разработки малоотходного способа реутилизации сернокислых отходов аккумуляторных батарей
Введение
Экологическая безопасность и эффективное функционирование экономики каждого государства неразрывно связаны с транспортной отраслью. Транспортные системы представляют собой объекты повышенного риска, оказывают влияние на жизнедеятельность населения, санитарно-эпидемиологическую и экологическую безопасность государства.
Одно из основных направлений государственной политики относительно вопросов экологической безопасности — развитие технологий переработки и утилизации отходов [1], в том числе отходов автомобильного транспорта, наиболее опасными из которых являются свинцово-кислотные аккумуляторы. Главная и наиболее опасная в экологическом плане проблема — выбрасывание отработанных аккумуляторов в окружающую среду. В настоящее время в Украине выбрасывается, если считать только аккумуляторы для автомобильного транспорта, около трех миллионов штук в год. Это приблизительно 80 — 90 тыс. т свинца и свинцовых соединений, не менее 21 тыс. т раствора серной кислоты [2].
Глава 1. Производство сульфата алюминия из отходов шамотного производства
В последнее время все больше внимания уделяется комплексной переработке различных видов минерального сырья с целью извлечения всех ценных компонентов, что позволяет достигнуть высоких технико-экономических показателей. Одним из таких видов является алюминийсодержащее сырье — нефелины, алуниты, каолины и глины, минеральная часть углей и т. д., из которых могут быть получены глинозем, соли алюминия, сода, поташ, сернокислый калий, шлам (сиштоф) для получения цемента, а также редкие металлы. Способы переработки алюминийсодержащего сырья можно разделить на кислотные, щелочные и комбинированные [3].
Возможность осуществления селективного разделения трудно растворимого в кислотах кремнезема от глинозема на первом технологическом переделе — сульфатизации позволяет значительно разрабатываемые технологические схемы переработки высококремнистого алюминиевого сырья. Кислотные способы вызывали повышенный интерес еще в конце Х1Х столетия. Однако лишь в последние десятилетия, в связи с появлением хороших кислотостойких материалов, повышенное внимание исследователей вновь направлено на разработку этих методов. Исследования в основном проводятся в двух направлениях: получение солей алюминия, преимущественно сернокислых, и глинозема для металлургических целей. Способы получения сернокислого алюминия, как более простые, вышли за рамки лабораторных исследований и в настоящее время применяются в промышленности.
Основными потребителями сернокислых солей алюминия являются коммунального хозяйства, где они применяются как коагулянт для очистки питьевой воды, и целлюлозно-бумажная промышленность, использующая этот продукт для технологических целей ( проклейка бумаги и картона ) и для водоподготовки.
Ассортимент выпускаемой продукции включает очищенный сернокислый алюминий в твердом виде и в растворе, получаемый из AL2O3, и неочищенный нефелиновый коагулянт из нефелинового концентрата. В небольших количествах получают AL2(SO4)3 из бокситов и каолинов, а также алюмокалиевые квасцы из алунитов.
Широкое распространение каолинов, большие запасы и поверхностное залегание, что позволяет организовать открытую добычу, с давних пор вызывают повышенный интерес исследователей к разработке рациональной технологии переработки [1].
Каолинами и глинами называют смесь различных кристаллических минералов, погруженных в коллоидные вещества, которые состоят главным образом из желатинозного силиката алюминия, кремниевой кислоты и гидроокиси железа, реже — гидроокиси алюминия.
Среди минералов глиноземистых глин различаются следующие группы: каолинитовая, монтмориллонитовая, аллофановая. В глинах чаще всего встречается минерал каолинит.
В качестве основных примесей присутствуют кварц, слюды, карбонаты кальция, магния и др.[3]
Современное производство очищенного сернокислого алюминия основано на применении в качестве сырья гидроксида алюминия, однако он является дорогостоящим и дефицитным сырьем в нашей стране. Именно поэтому разрабатываются методы переработки каолинов.
Сернокислый алюминий получают из каолинов двух видов: неочищенный и очищенный. Неочищенный сернокислый алюминий раньше получали из необожженой каолиноиой глины, которую сушили в пламенной печи при температуре 300-400 С. Каолин обрабатывали в варочном котле при 105-110 С в течение 6-8 ч и массу, содержащую 6-8 % свободной серной кислоты, затем выдерживали в зрельниках до содержания 2-2,5% свободной H2SO4 . Массу выгружали на кристаллизационный стол. Содержание AL2O3 в продукте составляло 9% , свободной H2SO4 не более 2%, железа (в пересчете на Fe2O3) — не выше 0,8% , нерастворимого остатка — не более 23%. Способу присущи существенные недостатки: большая доля ручного труда и очень низкое содержание оксида алюминия при сравнительно высоком содержании нерастворимого остатка.
При обработке обожженного при 700-800 С каолина серной кислотой разложение завершалось в варочных котлах, что исключало дозревание массы в зрельниках. Предложены различные способы механизации кристаллизации продукта: распыление незастывшей массы, кристаллизация на вращающихся барабанах с внутренним водяным охлаждением или в шнеках, в вагонетках с откидными полыми водоохлаждаемыми стенками, в ковшевых конвейерах и др.
Наиболее удачный способ механизации удаления застывшего продукта удалось разработать при разложении каолина избытком серной кислоты с последующей рейтрализацией ее нефелином.
Для исключения обжига каолина предлагали сырой природный каолин обрабатывать большим избытком серной кислоты с последующей нейтрализацией избытка нефелиновой мукой. Применение нефелиновой муки позволяет усовершенствовать разложение каолина, но не увеличивает содержание AL2O3 в продукте выше 9-10% и не снижает содержание нерастворимого остатка. Кроме того, значительное количество кислоты взаимодействует с оксидами щелочных металлов. Образующиеся сульфаты натрия и калия не принимают участия в очистке воды.
Являются балластом, засоряющим питьевую воду.
В Польше разработан способ производства неочищенного коагулянта из глин, заключающийся в том, что сырую глину обрабатывают раствором серной кислоты в автоклавах при температуре 170-190 С. Избыток свободной H2SO4 в пульпе нейтрализуют обожженной глиной. Продукт содержит 7% растворимого AL2O3, 0,5% Fe2O3, 2% свободной H2SO4 и 37% нерастворимого остатка. В работе отмечается, что наличие в коагулянте аморфного SiO2 в виде нерастворимого остатка способствует улучшению коагулирующих свойств продукта.
Производство очищенного сернокислого алюминия из каолинов в небольших количествах было организовано еще в довоенные годы. Каолин обжигали при 750-850 С, разлагали серной кислотой при температуре кипения, пульпу разбавляли и фильтровали. Раствор упаривали и кристаллизовали. Трудность отделения сернокислого раствора от кремнеземистого шлама в процессе фильтрации требует разбавления и упаривания, что сопряжено с усложнением технологической схемы и увеличением тепловых затрат.
Существует также способ, по которому сырую глину смешивают с оборотным маточным раствором и разлагают серной кислотой, взятой в большом избытке, в автоклавных условиях при температуре 170-180 С. Пульпу фильтруют, раствор упаривают в аппаратах с погружными горелками и проводят двухстадийную кристаллизацию. На первой стадии при 50 С кристаллизуют сернокислое железо, содержащее незначительное количество сернокислого алюминия. Продукт используют в качестве коагулянта для очистки сточных и питьевых вод. Во второй стадии кристаллизации после центрифугирования и промывки получают чистый Сернокислый алюминий. Одним из основных затруднений является отделение высококремнеземистого шлама от сернокислотного раствора.
Отстой одновременно является фильтром для очистки готового продукта от нерастворимых примесей. По действующей в настоящее время технологической схеме измельченный каолин подвергают пластификации в валковой дробилке. Каолиновые пластины толщиной 1-3 мм поступают на дегидратирующий обжиг в кольцевую печь с вращающейся подиной. Обжиг проводят при температуре 600-800 С, высота слоя каолина в печи 250 мм. Обожженные каолиновые пластинки загружают в реактор для обработки серной кислотой при температуре 105-115 С. Кристаллизация продукта производится на складе готовой продукции при естественном охлаждении. Закристаллизовавшийся AL2(SO4)3 рыхлят бульдозером с помощью грейферного крана и погрузочной маширой подают в вагоны.
Этот способ по сравнению с ранее известными имеет ряд преимуществ, так как исключаются операции разбавления суспензии после экстрагирования серной кислотой, трудоемкие процессы фильтрования и упаривания растворов сернокислого алюминия. В то же время способу присущи существенные недостатки. Это, прежде всего, сложный процесс подготовки сырья. Применение слоевого обжига приводит к тому, что верхние слои переобжигаются, в нижних слоях происходит недожег. Все это приводит к тому, что из каолина, обожженного в верхних слоях, извлечь полностью оксид алюминия не удается из-за образования труднорастворимого в серной кислоте муллита (AL2O3.3SiO2). Из необожженного каолина нижних слоев AL2O3 также не изивлекается полностью. При обжиге каолина в кольцевой печи большое количество обжигаемого материала просыпается через колосниковую решетку, который затем вновь проходит всю систему подготовки и обжига сырья. Продукты сгорания при 700-800 С разбавляются холодным воздухом и выбрасываются в атмосферу, что снижает тепловой к.п.д.
Применение перколяционной экстракции с рециркуляцией сернокислотного раствора не позволяет обеспечить малую длительность процесса (экстракция 24-26 ч, весь цикл — 40 ч ). Дозировка кислоты составляет 70% стехиометрической в расчете на кислоторастворимый AL2O3 в обожженном каолине. Малая дозировка H2SO4 , подача ее в реактор небольшими порциями и большая длительность экстракции приводит к значительной потере реагентов ( AL2O3 и H2SO4 ) вследствие образования труднорастворимых основных сернокислых солей алюминия, которые удаляются со шламом — сиштофом. Общее извлечение оксида алюминия не привышает 50-55%, что приводит к большому расходу каолина. Раствор сернокислого алюминия с содержанием 13,5% AL2O3 не кристаллизуется на столах.
В ИОНХ АН УССР совместно с Институтом газа АН УССР разработан непрерывный способ получения сернокислого алюминия из каолинов (рис. 1.1 )Сущность технологического процесса заключается в том, из каолина и раствора сернокислого алюминия готовится пульпа влажностью 50-55%, которая поступает на грануляцию в аппарат кипящего слоя при температуре 200-230 С. В грануляторе наряду с гранулированием происходит удаление свободной влаги и частичное обезвоживание сернокислого алюминия, подаваемого с промывными водами. Из гранулятора гранулы ячейковым питателм подаются на обжиг в печь кипящего слоя при температуре 560-580 С. Обожженные гранулы охлаждаются воздухом в холодильнике кипящего слоя и выгружаются в приемный бункер. Воздух после холодильника соединяется с дымовыми газами гранулятора и очищается в циклоне и мокром скруббере. Дымовые газы после обжиговой печи очищаются в циклоне, промывной башне и волокнистом фильтре.
Охлажденные обожженные гранулы подаются на противоточную экстракцию раствором серной кислоты при температуре 100-110 С в барабанный аппарат непрерывного действия, изготовленный из стали ЭИ-943. Навстречу движущимся гранулам непрерывно поступает концентририванная серная кислота ( 93% ) и вода. Вода промывает прореагировавшие гранулы и разбавляет серную кислоту, поступающую на взаимодействие с каолином. Выгрузка прореагировавших гранул происходит с противоположного конца от загрузки обожженного каолина. Таким образом, в одном аппарате одновременно и непрерывно осуществляется взаимодействие каолинита с серной кислотой, промывка и отделение сиштофа. Степень извлечения оксида алюминия в раствор составляет 88-92%. Концентрированный раствор сернокислого алюминия с содержанием 12-13% AL2O3 и до 4% нерастворимого остатка подвергают контрольной фильтрации через слой прореагировавших гранул в присутствии флокулянта ПАА в количестве 18 г/м3 раствора. Осветленный раствор сернокислого алюминия поступает на грануляционное обезвоживание в аппарате кипящего слоя при температуре 180-200 С. После гранулятора получают сернокислый алюминий с содержанием 22-26% AL2O3.
Пыль AL2(SO4)3, уловленная в циклонах, частично поступает на приготовление пульпы, а большей частью подвергается грануляции на тарельчатом грануляторе. Сиштоф после сушки используют в качестве кристаллизационного компонента при получении цемента. Добавка кристаллизационного компонента значительно повышает прочность и придает специальные свойства кальциевым цементам, являющимся основным строительным материалом в народном хозяйстве.
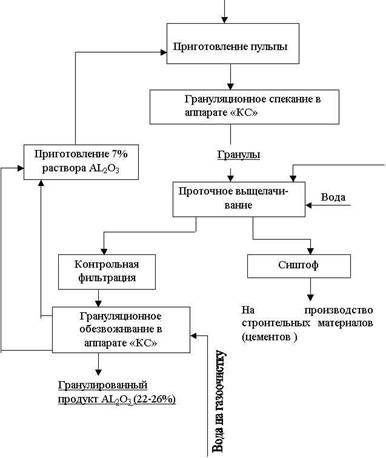
Рисунок 1.1— Принципиальная схема непрерывного способа получения гранулированного сернокислого алюминия из каолинов
К преимуществам этого метода следует отнести :
1. упрощение подготовки сырья ( исключаются размол, сушка ); приготовление пульпы позволяет подать в обжиговую печь со стабильными физико-химическими свойствами, что не требует постоянного вмешательства в работу обжиговых печей; улучшаются санитарно-гигиенические условия труда, так как уменьшается запыленность подготовительного отделения;
2. применение для приготовления пульпы в качестве связующего раствора сернокислого алюминия позволяет получить гранулы с большой прочностью. Это уменьшает пылеунос в процессе грануляционного спекания из аппаратов кипящего слоя, позволяет осуществить процесс в барабанном противоточном аппарате непрерывного действия;
3. грануляция и обжиг в аппаратах кипящего слоя позволяют одновременно с выгрузкой осуществить сепарацию гранул, таким образом, направлять на экстракцию материал постоянного гранулометрического состава;
4. сернокислая экстракция в барабанном аппарате непрерывного действия совмещена с промывкой и отделением кремнеземистого шлама — сиштофа. Непрерывная подача реагентов и малая длительность процесса позволяют достичь относительно высокой степени извлечения оксида алюминия в раствор ( более 80%);
5. осуществление обезвоживания и грануляции концентрированных растворов сернокислого алюминия в аппарате кипящего слоя позволяет получать частично обезвоженный гранулированный неслеживающийся продукт с высоким содержанием основного компонента —AL2(SO4)3 (22-26%);
6. значительное сокращение производственной площади;
7. весь процесс непрерывен и может быть автоматизирован.
К числу недочетов следует отнести необходимость упаривания воды каолинивой пульпы, что сопряжено с повышенными тепловыми затратами. Однако осуществить грануляцию и даже пластификацию каолинов невозможно. Применяя печи кипящего слоя удается значительно сократить расход тепла по сравнению с кольцевыми печами.
Интересными представляются направления совершенствования технологии переработки каолинов технической серной кислоты отходами производстваю Так, предлагается использовать отработанные тревильные растворы после окисления Fe2+ в Fe3+ продувкой воздухом направляют на втоклавное разложение при температуре 100-300 С и давлении 7-350 атм. В результате реакции обмена получают в растворе сульфат алюминия и в осадке — Fe(OH)3 и SiO2. После фильтрации раствор сульфата алюминия, содержащий примеси FeSO4, обрабатывают каменным углем или пропускают сернистый ангидрид в присутствии 40-47%-ной H2SO4, осаждая из раствора FeSO4.7H2O. При охлаждении раствора кристаллизуют AL2(SO4)3.16—18H2O высокой чистоты.
Из рассмотренных ранее способов получения сульфата алюминия следует, что в большинстве из них не решен вопрос глубокой очистки растворов от железа. Между тем в настоящее время в ряде производств к сернокислому алюминию предъявляются жесткие требования по содержанию железа. Сущность способа получения сернокислого алюминия высокой чистоты (рис. 1.2 ) в том, что каолин смешивают с серной кислотой в количестве около 20% и промывной водой 2%. Пульпу подвергают грануляционному спеканию при температуре 200-230 С и обжигу при 560-580 С в печах кипящего слоя. Обожженные гранулы разлагаются в барабанных аппаратах противоточного типа непрерывного действия. Слив поступает на контрольную фильтрацию и затем на восстановление сульфата трехвалентного железа до двухвалентного алюминиевой стужкой при 98-100 С. Из сернокислого раствора в автоклавах кристаллизуют водородный алунит при 230 С в течение 1ч в присутствии восстановленного водородного алунита, который подается в количестве 60-65% от имеющегося в растворе глинозема. Восстановительный обжиг проводят при 560-580 С. В качестве восстановителя могут использовать конвертированный природный газ, генераторный газ, пары солярного масла, сера и др. Химизм процесса можно представить суммарной реакцией:
H2[AL2(SO4)4(OH)12] + 4CO 3AL2O3 +7H2O + 4SO2 + 4CO2 .
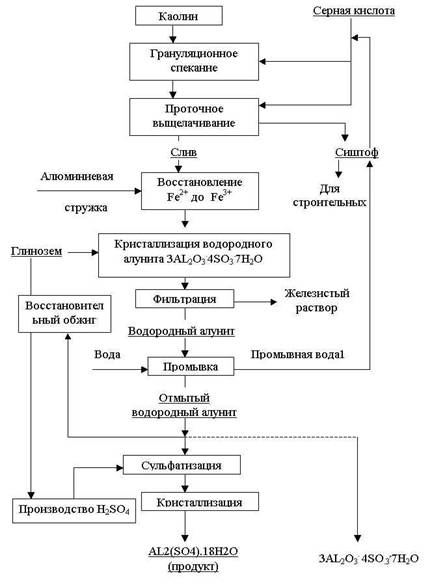
Рисунок 1.2 — Принципиальная технологическая схема производства сернокислого алюминия высокой чистоты из каолинов.
При восстановительном обжиге содержание активного AL2O3 возрастает на 33% , а возврат безводного сернокислого алюминия на кристаллизацию водородного алунита полностью исключается.
При автоклавном гидролизе осуществляется полный вывод оксида алюминия в твердую фазу в виде водородного алунита. В маточном растворе остается сульфат двухвалентного железа, который отделяется фильтрованием . Это позволяет исключить из технологического передела операции обезжелезивания обожженным каолином, фильтрацию и промывку железистого шлама. В результате потери глинозема в процессе обезжелезивания отсутствуют, упрощается аппаратурное оформление, сокращается количество промывных вод.
Водородный алунит промывают водой. Промывная вода1 поступает большей частью на промывку сиштофа, а также на приготовление пульпы. Отмытый водородный алунит разлагают серной кислотой в стехиометрияеском количестве с получением сернокислого алюминия. Для сульфатизации используют раствор серной кислоты такой концентрации, чтобы получить раствор концентрацией до 15% AL2O3, который можно было бы подавать непосредственно на кристаллизацию товарного AL2(SO4)3.
Водородный алунит может выдаваться в виде полупродукта. Он обладает лучшими транспортабельными свойствами, чем 18-водный сернокислый алюминий.
В процессе сульфатизации извлечение глинозема в раствор 90-92%. Из раствора кристаллизуют водородный алунит следующего химического состава, % : 39,8 AL2O3; 42,4 SO3; 17,8H2O; 0,001-0,003 Fe2O3. Из этого полупродукта получали сернокислый алюминий, в котором содержалось 0,0005-0,001% Fe2O3.
Из сопоставления этого способа с ранее известными видно, что он имеет ряд преимуществ, которые заключаются в следующем :
1. из технологического процесса исключены операции обезжелезивания каолином, контрольной фильтрации, промывки железистого шлама;
2. кристаллизация водородного алунита проводится в присутствии восстановленного продукта гидролиза, что позволяет при одном и том же расходе его увеличить долю активного AL2O3 на 33 % ;
3. в процессе автоклавного гидролиза достигается полный вывод алюминия из раствора, что позволяет удалить железо из процесса, а также уменьшить грузопотоки на стадиях грануляционное спекание — кристаллизация;
4. водородный алунит может выдаваться в виде полупродукта и транспортироваться к месту потребления. Это позволяет стоить мощные предприятия по получению его вблизи сырьевой базы;
5. процесс может быть осуществлен в непрерывном цикле, что позволит его автоматизировать.
Исходным сырьем для получения неочищенного нефелинового коагулянта является нефелиновый концентрат и контактная серная кислота. Неочищенный нефелиновый коагулянт имеет состав, % : 10-12 AL2O3; 0,5-0,9 Fe2O3 и 23-29 нерастворимый остаток.
Производство его осуществляется по трем технологическим схемам.
Так, по одной из них нефелиновый концентрат смешивают с купоросным маслом, при этом концентрат с крепкой серной кислотой практически не взаимодействует, полученная суспензия дозируется ковшевым дозатором в горизонтально расположенный шнек-реактор, куда подается вода из расчета разбавления кислоты до 70-73%. После разбавления реакция протекает с разогревом массы и испарением воды. В результате прохождения через три последовательно расположенных шнека-реактора она становится сыпучей, слегка влажной. Выгружаемый из последнего реактора продукт транспортируется на склад, где происходит его дозревание в течение 2-4 суток, после чего он отгружается потребителю. Вызревание на складе необходимо вследствие того, что разложение а шнеках-реакторах проходит лишь на 85-89% и резко замедляется из-за недостатка жидкой фазы. При дозревании степень разложения увеличивается до 91-93%. Этот способ устарел. Он характеризуется низким коэффициентом использования основного оборудования — шнеков-реакторов вследствие интенсивного эрозионно-коррозионного износа материала аппаратуры, необходимостью дозревания продуктов на складе, неудовлетворительными санитарно-гигиеническими условиями.
По второй технологической схеме нефелиновый концентрат разлагается разбавленной H2SO4 (35-40%) в баке с мешалкой в периодических условиях. Суспензия выливается на кристаллизационный стол, где застывает и разрезается на куски. Степень разложения концентрата достигает 95%. Этот способ исключает дозревание продукта на складе, но также характеризуется низким содержанием AL2O3 в продукте и периодичностью процесса.
Третья технологическая схема разработана УНИИХИМом и получила название "камерный способ". Нефелиновый концентрат непосредственно смешивают с разбавленной серной кислотой (65-70%) в турбинном вертикальном смесителе непрерывного действия. Полученная пульпа вытекает в камеру аналогичную суперфосфатной, где через 25-30 мин. запустевает, образуя так называемый пирог. Время пребывания массы в камере составляет 1ч. Вырезанный фрезой камерный продукт подается транспортером и разбрасывается на склад. Дозревание продукта на складе не требуется, так как степень разложения концентрата на выходе из камеры 92,5%.
"Камерный" способ производства выгодно отличается от первых двух применением высокопроизводительного оборудования, непрерывностью процесса, высоким коэффициентом использования оборудования, несколько лучшими санитарно-гигиеническими условиями. На 1т нефелинового коагулянта расходуется 0,43т серной кислоты и 0,39т нефелинового концентрата [1].
Рассмотрим щелочные способы переработки алюминийсодержащего сырья.
Получение глинозема способом спекания применительно к каолиновым глинам, аргиллитам и минеральной части углей разработано В.А. Мазелем, Н.И. Ереминым и др.[3]. Каолин и известняк и спекают из расчета связывания кремнезема в 2CaO.SiO2 и глинозема в 12CaO.7A2O3 при 1375-1400 С с последующим саморассыпанием спеков при охлаждении.
Комплексная переработка нефелинового концентрата и породы на глинозем, соду, поташ и цемент способом спекания осуществлена на ряде предприятий.
По этому способу нефелиновый концентрат или породу смешивают с предварительно измельченным известняком и спекают при 1250-1300 С, При этом глинозем, содержащийся в нефелине переводят в хорошо растворимые в водных и щелочных растворах алюминаты натрия и калия, а кремнезем связывают в нерастворимый двухкальцевый силикат. Охлажденный спек размалывают в шаровых мельницах, где размол совмещен с выщелачиванием оборотными растворами щелочей для извлечения алюминатов. При этом происходит также частичное разложение двухкальциевого силиката, сопровождаемое некоторым переходом в раствор кремнезема. После отделения твердого остатка и очистки от кремнезема алюминатные растворы разлагают с выделением гидроокиси алюминия, после прокалки которой получают глинозем. Содопоташные растворы, свободные от алюминия, выпаривают и разделяют с получением твердой соды и поташа, а двухкальциевый силикат направляют на получение цемента, кроме того, получают еще и галлий.
Гидрохимический способ В.Д. Пономарева и В.С. Сажина состоит в том, что в определенных условиях автоклавной варки нефелинов и других алюмосиликатов в едкой щелочи, окись алюминия почти полностью переходит а раствор и может быть отделена от кремнезема и других примесей.
При выщелачивании нефелинов в присутствии извести под давлением 30 атм (260 С ) крепкими щелочными растворами получают алюминатный раствор, содержащий некоторое количество кремнезема. Раствор обезкремнивают в присутствии оборотного белого шлама при 150 С, отделяют от выпавшего осадка и упаривают до 500-510 г/ Na2O, после чего из него кристаллизуют алюминат натрия, который затем растворяют и направляют на декомпозицию по Байеру. Остаток после выщелачивания промывают и регенерируют из него щелочь обработкой известью в автоклавах или слабыми растворами щелочей. Гидрохимический способ прошел укрупненную проверку. В последние годы В.С. Сажиным с сотрудниками предложен ряд усовершенствований гидрохимического способа [ 3 ].
Способ спекания высокощелочной шихты, предложенный М.Н. Смирновым, заключается в замене половины известняка в обычной нефелиновой шихте эквивалентным количеством едкой щелочи. При спекании такой шихты образуются алюминаты и ферриты щелочей, а кремнезем связывается не в 2CaO.SiO2, а в Na2O.CaO.SiO2, т.е. одна молекула CaO замещается молекулой Na2O.
Преимущество способа по сравнению с обычным спеканием состоит в уменьшении почти в 2 раза расхода известняка, в хорошей грануляции шихты, большом температурном интервале спекообразования (около 300 С ). Недостатком схемы является большой расход щелочи и сложность регенерации ее из шлама [ 3 ].
Глава 2. Обеспечение экологической безопасности путем разработки малоотходного способа реутилизации сернокислых отходов аккумуляторных батарей
Экологическая безопасность и эффективное функционирование экономики каждого государства неразрывно связаны с транспортной отраслью. Транспортные системы представляют собой объекты повышенного риска, оказывают влияние на жизнедеятельность населения, санитарно-эпидемиологическую и экологическую безопасность государства.
Одно из основных направлений государственной политики относительно вопросов экологической безопасности — развитие технологий переработки и утилизации отходов [1], в том числе отходов автомобильного транспорта, наиболее опасными из которых являются свинцово-кислотные аккумуляторы. Главная и наиболее опасная в экологическом плане проблема — выбрасывание отработанных аккумуляторов в окружающую среду. В настоящее время в Украине выбрасывается, если считать только аккумуляторы для автомобильного транспорта, около трех миллионов штук в год. Это приблизительно 80 — 90 тыс. т свинца и свинцовых соединений, не менее 21 тыс. т раствора серной кислоты [2].
В настоящее время в сфере обращения с сернокислыми аккумуляторными отходами используется в основном нейтрализация щелочными реагентами.
Недостатки этого способа следующие [3]:
• образование больших объемов жидких отходов, в том числе содержащих тяжелые металлы;
• использование щелочных реагентов (известковое молоко, известняк, аммиачная вода и др.), их транспортировка, хранение; " потеря дорогого продукта — серной кислоты, которую можно использовать повторно.
На базе Донбасской национальной академии строительства и архитектуры разработан безреагентный электрохимический способ реутилизации электролита отработанных свинцово-кислотных аккумуляторов с извлечением серной кислоты.
Для описания процесса регенерации сернокислых растворов, содержащих примеси металлов, можно использовать известные теоретические закономерности электрохимической обработки растворов с определенной корректировкой, учитывающей состав отработанного раствора, концентрацию примесей и специфику решаемых задач.
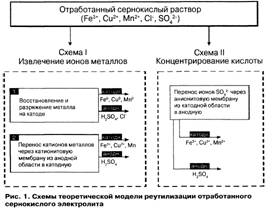
Существуют две схемы теоретической модели реутилизации отработанного сернокислого электролита (рис. 1). Схема I направлена на извлечение примесных металлов из отработанного раствора электролита, схема II — на концентрирование серной кислоты. Возможность реализации приведенных схем зависит от закономерностей поведения исследуемых катионов и анионов под действием постоянного тока в 18 — 34 %-ной серной кислоте.
Схема I электрохимической регенерации отработанного аккумуляторного электролита, содержащего катионы железа, меди, марганца, а также анионы хлористых соединений и серной кислоты, предполагает протекание процесса в двух направлениях. Первое направление — восстановление ионов металлов в катодной области с последующим их разряжением на катоде:
Ме"+ + е -" Me""1;
Ме"+ + т -> Ме°.
В этом случае предполагается уменьшение концентрации ионов Fe3+, Cu2+, Мп2+ в электролите катодной области, в растворе остаются анионы серной кислоты и хлористых соединений.
Если электрод подвергнуть катодной поляризации, т.е. пропустить через него постоянный ток, то суммарный ток катодных реакций будет больше тока анодных на величину внешнего тока. Как только потенциал тока при определенной его плотности превысит значение равновесного потенциала металла, на катоде рядом с водородом начнет выделяться металл:
Ме"+ + пе -> Ме°(тах);
2Н + 2е ->Н,Т(гшп).
При увеличении плотности тока будет происходить в основном разряд ионов металла, количество выделившегося водорода будет снижаться до минимума. При дальнейшем увеличении плотности тока скорость разряда ионов металла может превысить скорость поступления их в прикатодный слой и концентрация ионов в прикатодном слое станет равной или близкой к нулю. При этом произойдет резкий скачок потенциала и ионы водорода начнут разряжаться на металле в значительном количестве:
2Н++ 2е ->Н2Т(тах);
Ме"+ + ие -> Me°(min).
Значения величины тока при максимальном выделении металла из раствора будут соответствовать предельному току, величина которого зависит от условий протекания электрохимического процесса и, в первую очередь, от концентрации извлекаемых ионов металла.
При низкой концентрации металла в растворе при прохождении постоянного тока в соответствии с теорией замедленного разряда на катоде начнет выделяться водород вместе с металлом. При достижении низких критических концентраций извлекаемого металла, может наступить момент, когда на катоде будет выделяться только (или преимущественно) водород, поскольку концентрация его в катодном растворе остается постоянной. Этому способствует постоянное образование на аноде катиона водорода (Н+). Скорость диффузии ионов водорода значительно выше скорости диффузии ионов металла, поэтому из объёма раствора к катоду быстрее подойдут ионы водорода, а не ионы металла.
Дополнительным фактором, препятствующим выделению металлов на катоде, является наличие примесей железа. При содержании железа более 20 мг/л выход по току выделяемого металла резко падает. Негативное влияние железа объясняется тем, что на катоде одновременно выделяются и извлекаемый металл, и железо, у которого перенапряжение выделения водорода ниже, чем у других металлов.
Входящие в состав аккумуляторного электролита ионы железа и марганца, расположенные в ряду напряжений левее водорода, способны вытеснять его из кислот [3]. Описанный процесс будет препятствовать выделению железа и марганца на катоде в сернокислом аккумуляторном электролите, концентрации ионов водорода в котором выше концентрации ионов металлов в 3000 раз. По литературным данным, выделение железа на катоде начинается с момента, когда концентрация серной кислоты снижается до 15 г/л [4]. Марганец является одним из наиболее электроотрицательных металлов, его стандартный потенциал Ф°мп/мп" = -1,18 В. Поэтому выделить марганец на катоде в кислой среде не удается.
Однако электролитическое железо может представлять интерес только в двух случаях: при получении очень чистого железа или железного порошка. Для решения поставленной в работе задачи реутилизации аккумуляторного электролита представляет интерес тот факт, что ионы Fe3+ в аккумуляторе попадают к отрицательному электроду и восстанавливаются свинцом, т.е. вызывают саморазряд отрицательного электрода. Если же эти ионы будут находиться в электролите в двухвалентном состоянии, то они не будут оказывать отрицательного влияния на эксплуатационные характеристики аккумуляторной кислоты.
Согласно рассмотренным закономерностям можно утверждать, что при регенерации растворов отработанного аккумуляторного электролита, в которых концентрация ионов водорода значительно превышает концентрацию ионов металлов (СМе~ " Си*), металлы на катоде выделяться не будут. Второе направление — перенос катионов Fe3+, Cu2+, Мп2+ через катионитовую ионообменную мембрану из анодной области в катодную. В результате концентрирования ионов металлов в катодной области в анодной области можно получить очищенный раствор серной кислоты, не содержащий примесей металлов. При этом ионы С1" окисляются на аноде до С12 и выделяются в виде газа [5]. На результат данного процесса влияют катодная плотность тока и время проведения процесса с катионов Fe3+, Cu2+, Мп2+ через катионитовую ионообменную мембрану из анодной области в катодную.
В результате концентрирования ионов металлов в катодной области в анодной области можно получить очищенный раствор серной кислоты, не содержащий примесей металлов. При этом ионы С1" окисляются на аноде до С12 и выделяются в виде газа [5]. На результат данного процесса влияют катодная плотность тока и время проведения процесса. Согласно теоретическим исследованиям на результат процесса извлечения примесных металлов из отработанного раствора электролита влияют следующие факторы:
в катодная плотность тока;
• концентрация ионов водорода (кислотность среды);
• начальная концентрация ионов серной кислоты и примесных металлов;
в время проведения процесса.
Схема II реутилизации аккумуляторного электролита предполагает извлечение серной кислоты из отработанного сернокислого раствора [4]. Выделение серной кислоты из регенерата может быть достигнуто в двухкамерной ячейке со свинцовым анодом и анионитовой мембраной. Извлечение сернокислого марганца из раствора серной кислоты может быть осуществлено в двухкамерном электродиализаторе, разделенном анионо-обменной мембраной. Регулируя силу тока и подачу исходного раствора в катодную камеру, можно добиться такой работы системы, что из анодной камеры будет выходить чистая серная кислота, а из катодной — сернокислый марганец. Под действием тока сульфат-ионы переходят из католита в анолит. На аноде происходит разложение воды по реакции Н20 - 2ё -> 1/202 + 2Н+, причем выделяется газообразный кислород, а ионы водорода остаются в растворе и образуют с сульфат ионами раствор серной кислоты. Загрязняющие электролит примеси металлов (железо, медь, марганец, хлориды, свинец) концентрируются в катодной области.
При исследовании процесса регенерации серной „ кислоты в качестве выходных параметров следует рассматривать конечную концентрацию кислоты в камере концентрирования и энергетические затраты.
Количественными факторами, определяющими процесс извлечения серной кислоты из отработанного электролита свинцово-кислотных аккукмуля-торов, являются:
S катодная плотность тока;
s время протекания процесса;
s степень воздействия процесса регенерации на окружающую среду.
В результате проведенных теоретических и экспериментальных исследований предложена следующая схема утилизации отработанного аккумуляторного электролита: удаление взвешенного свинца (отстаивание, центрифугирование) -" электрохимическая регенерация сернокислотного раствора -> утилизация образовавшихся отходов.
Из отслуживших свой срок свинцовых аккумуляторов сливают электролит в отстойник (первая операция), в котором он находится не менее 24 ч. Это время необходимо для осветления электролита. Осветлённый электролит, содержащий 0,001 % по массе соединений свинца, подаётся на электрохимическую обработку (вторая операция). Осевший аккумуляторный шлам собирается, удаляется из отстойника и подается в технологический процесс переработки свинцового шлама. После завершения цикла электрохимической обработки раствор подаётся в ёмкость, в которой контролируются параметры электролита (ГОСТ 667-73) и, при необходимости, проводится его корректировка (третья операция) добавлением аккумуляторной серной кислоты или дистиллированной воды. Откорректированный электролит разливается в тару и отправляется потребителю.
Из катодной камеры электродиализного аппарата сернокислый отбросной раствор, содержащий примеси металлов, подаётся на нейтрализацию (четвертая операция). В нейтрализатор при перемешивании поступает известь или известковое молоко. Процесс ведётся до достижения рН = 6 + 7. После отстаивания продуктов реакции (пятая операция) воду с осадка сливают и используют для заполнения анодной камеры или иных технологических мероприятий. Образовавшийся в ёмкости гипс удаляют и отправляют потребителю.
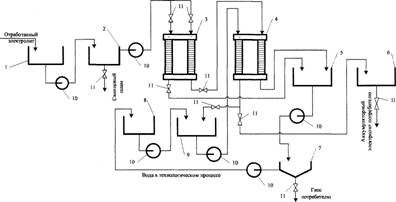
Для одновременного удаления ионов железа, меди, марганца, хлора, свинца электрохимическая очистка проводится в две стадии (рис. 2). Это обусловлено тем, что при прохождении постоянного тока через очищаемый сернокислый раствор наблюдается переход ионов меди из катодной области в анодную через анионитовую мембрану МА-40. Причем с увеличением плотности тока увеличивается интенсивность перехода, но в то же время растут и затраты. Целесообразно проводить очистку от ионов меди при плотности тока 200 — 400 А/м2 в течение 1,7 — 2,5 ч. За данный интервал времени (1,7 ч при 300 - 400 А/м2 и 2,5 ч при 200 А/м2) содержание ионов меди в катодной области снижается до минимально возможного — 0,0001 % по массе. При дальнейшем ведении процесса содержание меди в катодной области электродиализатора не уменьшается или изменяется незначительно.
Для очистки от ионов железа, марганца, хлора, свинца раствор, уже освобожденный от ионов меди, помещают в катодную камеру двухкамерного электродиализатора (анодная камера заполнена 0,3 - 0,5 %-ной H2S04) и методом электродиализа при катодной плотности тока 600 — 1000 А/м2 извлекают серную кислоту из отходов аккумуляторного электролита.
Расход электроэнергии при проведении процесса электродиализа довольно значительный. Удельный расход электроэнергии в процессе удаления избыточной кислотности при заданном расстоянии между мембранами и рабочим сечением электродиализатора определяется разностью концентраций ионов в соседних камерах. Чем выше исходная кислотность, тем больше требуется энергии для получения заданной кислотности. Поэтому выгоднее вести процесс последовательно, число ступеней должно быть тем больше, чем выше исходная кислотность и чем ниже конечная.
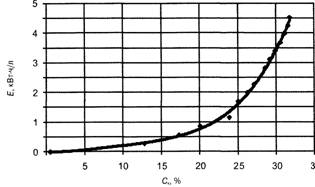
Согласно полученным данным (рис. 3) по мере накопления очищенной кислоты в анодной области возрастают и затраты энергии в соответствии с выражением у = lO5*4 - 0,0004л:3 + 0,0052х2 -- 0,004л-; R2 = 0,9973, где х — концентрация очищенной кислоты.
Основные затраты энергии приходятся на концентрирование аккумуляторного раствора, в котором после электродиализа содержится 24 % по массе серной кислоты (см. рис. 3), поэтому необходимо добиться компромисса между выходом кислоты и затратами электроэнергии.
Для снижения затрат электроэнергии на процесс регенерации было предложено оценить эффективность двухступенчатого способа концентрирования.
Первая ступень процесса предполагает концентрирование серной кислоты в анодной камере в течение 5 ч до содержания 24 % по массе. Катодная плотность тока поддерживается на уровне 800 А/м2. Концентрация сульфат-ионов в катодной камере снижается до 11 — 12 % по массе.
На второй ступени процесса в анодную камеру электродиализатора заливают 0,5 %-ный раствор серной кислоты. В катодной камере находится частично исчерпанный аккумуляторный раствор, содержащий 11,5 % по массе серной кислоты. Кинетика второй ступени процесса (рис. 4) описывается выражением
у = -0,021л-3 - 0,4469х2 + + 4,375л- + 0,5669; R2 = 0,9946.
Согласно полученным данным процесс концентрирования целесообразно проводить в течение 3 ч: скорость процесса в это время достаточно высокая. В результате в анодной области концентрация серной кислоты повышается с 0,5 до 9,1 % по массе. Оставшийся в камере исчерпывания отработанный раствор, содержащий 1,9 — 2,1 % по массе серной кислоты, направляется на дальнейшую нейтрализацию. Причем в результате снижения концентрации кислоты в растворе, поступающем на нейтрализацию, уменьшается расход щелочных реагентов.
При применении двухступенчатого способа концентрирования уменьшается время процесса и, как следствие, общие энергозатраты снижаются в 1,75 раза, увеличивается выход по току в 2 раза при большом количестве перенесенной через мембрану кислоты (см. таблицу). При этом удельные энергозатраты, которые подсчитывались как отношение общих энергозатрат к массе перенесенной через мембрану серной кислоты, снизились в 1,98 раза. Снижение концентрации кислоты в отбросном растворе, поступающем на регенерацию, ведет к уменьшению расхода щелочных реагентов. Приведенные данные свидетельствуют о ресурсосберегающей направленности работы.
Таким образом, разработанный способ реутилизации сернокислых отходов аккумуляторных батарей позволяет обеспечить максимальный уровень экологической безопасности. При реализации разработанного способа устраняются опасные для окружающей среды отходы, извлекается и возвращается в производство свинцовых аккумуляторов серная кислота, меньшее количество жидких отходов с более высоким рН поступает на нейтрализацию, а следовательно, уменьшается количество щелочных реагентов, необходимых для нейтрализации. Из 1 т отработанного 18 — 34 %-ного электролита может быть получено 0,92 т серной кислоты (в пересчете на чистую серную кислоту), соответствующей ГОСТ 667-73.
Глава 4. Организационные и технологические решения при обезвреживании и утилизации отработанного сернокислотного электролита аккумуляторных батарей
сернокислый реутилизация аккумуляторная батарея
В последнее десятилетие на территории Центрально-Черноземного региона РФ, как и в целом по России, значительно возросло количество единиц автотранспорта (по некоторым оценкам в 5 раз), что увеличило техногенную нагрузку на окружающую среду.
В связи с этим фактом в настоящее время актуальны исследования, направленные на решение проблемы загрязнения окружающей среды свинецсодержащими отходами, источником которых являются отработанные аккумуляторные батареи.
В 2000 г. в целях предотвращения загрязнения окружающей среды свинцом и его соединениями ООО "Экологические проекты ЦЧР" (Воронеж, Россия) организовало первое в Центрально-Черноземном регионе РФ предприятие по приему, обезвреживанию и утилизации отработанного сернокислотного электролита аккумуляторных батарей — отхода 2-го класса опасности (согласно Федеральному классификационному каталогу отходов РФ). Специалистами фирмы был разработан технологический регламент, которым обеспечивается:
• легко контролируемая система учета образования и утилизации свинецсодержащих отходов;
• переработка всех отходов в сырье;
• предотвращение несанкционированного сброса отходов в окружающую природную среду;
• исключение выбросов в атмосферный воздух;
• исключение образования дополнительных видов отходов. В технологический процесс включены следующие операции (оборудование ЗАО "Электрозаряд", г. Москва):
• прием отработанных аккумуляторных батарей; погрузка их на поддоны, окрашенные кислотостойкой краской; подача на площадку сортировки (при помощи такелажной тележки);
• сортировка аккумуляторов; подача на полипропиленовый стол под поддоны, а оттуда — на стол-приемник;
• слив отработанного электролита на специальном столе-приемнике, где производится очистка электролита от грубых примесей с обязательной пятиминутной выдержкой для полного слива электролита;
• загрузка слитых аккумуляторных батарей на поддоны и подача на площадку временного хранения и накопления аккумуляторов;
• подача электролита со стола-приемника на стол первичной фильтрации;
• первичная фильтрация электролита (отделение нерастворимых соединений свинца: сульфата и гидроокиси свинца) на специальном полипропиленовом столе первичной фильтрации при пропускании электролита через фильтровальную ткань (она может быть заменена на базальтовую вату или стеклосферическую загрузку);
• просушивание отфильтрованного осадка и складирование вместе со слитыми аккумуляторными батареями; подача электролита после первичной фильтрации в емкости-отстойники; перекачивание осветленного электролита (после 25 ч отстоя) в емкости-накопители; подача подсушенного осадка на площадку хранения слитых аккумуляторных батарей;
• временное складирование пластмассовых корпусов с сульфатированными пластинами и осадком;
• реализация обезвреженного электролита для использования в качестве кислотного реагента (5—10%-ный раствор серной кислоты);
• передача пластмассовых корпусов аккумуляторных батарей (с пластинами и осадком) на предприятия по переработке вторичного свинца. Состав и качество используемого оборудования при предварительной подготовке (промыв) позволяют производить обезвреживание как кислотного, так и щелочного электролита.
Ежегодно перерабатывается до 50 т свинецсодержащей аккумуляторной жидкости.
Литература
1. Дробноход МЛ. Концепція переходу України до стійкого екологічно безпечного розвитку. К.: 2000.
2. Вайсгант З.И., Хабачев М.Н. Экологические проблемы сбора и утилизации аккумуляторного лома. Тез. докл. II Междунар. науч.-практ. конф. "Управление отходами: отечественная и международная система экологического менеджмента — 2006".
3. Башевая Т.С., Сердюк А.И. Малоотходный способ утилизации отработанного сернокислого электролита аккумуляторных батарей
4. Башевая Т.С., Сердюк А.И., Ступин А.Б. Способы утилизации электролита отработанных свинцово-кислотных аккумуляторов
5. Каменев СБ., Прейс СВ., Сийрде Э.К. Электрохимическая очистка хлоратсодержащих сточных вод // Химия и технология воды. 1991. Т. 13. № 2
| Исследование возможности извлечения редких металлов из золы-уноса ТЭЦ ... | |
|
Министерство общего и профессионального образования Российской Федерации ДИПЛОМНАЯ РАБОТА Исследование возможности извлечения редких металлов из золы ... Разлагать сплав можно как выщелачиванием измельченного сплава серной или соляной кислотой, так и анодным растворением [2]. В раствор наряду с галлием и алюминием переходят также ... Процесс включает 3 операции: двухстадийное выщелачивание серной кислотой при двух различных концентрациях, концентрирование редких металлов из раствора с применением хелатных смол ... |
Раздел: Рефераты по технологии Тип: реферат |
| Изучение и анализ производства медного купороса | |
|
Введение Целью данного дипломного проекта является изучение и анализ производства медного купороса, основанного на переработке отработанного ... Поэтому находящуюся в выделенном электролите серную кислоту нейтрализуют материалами, содержащими медь, катодным скрапом, стружкой, гранулированной катодной и анодной медью, шлаком ... Процесс получения насыщенного раствора сернокислой меди - глубокая нейтрализация свободной серной кислоты, содержащейся в отработанном электролите ЦЭМ и маточных растворов ... |
Раздел: Рефераты по химии Тип: дипломная работа |
| Анализ азота и его соединений | |
|
АЗОТ И ЕГО СОЕДИНЕНИЯ В обычных условиях N2- физиологически индифферентный газ. Почти все летучие соединения N2 ядовиты. Аммиак NH3 сильно раздражает ... В среде концентрированной серной кислоты нитрат-ионы реагируют с салицилатом натрия, образуя смесь 3-нитросалициловой и 5-нитросалициловой кислот, соли которых в щелочной среде ... Реакции образования окрашенного соединения мешают ионы сурьмы, висмута, железа (III) , свинца, ртути, но это предусмотрено в ходе определения: ионы указанных металлов образуют ... |
Раздел: Рефераты по химии Тип: реферат |
| Программа для поступающих в вузы (ответы) | |
|
Программа по химии для абитуриентов Предмет химии. Явления химические и физические. Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и ... 1) ионы металлов от лития до алюминия не восстанавливаются, но идет процесс восстановления водорода из воды, 2) ионы металлов от алюминия до водорода восстанавливаются до металлов ... Сульфат алюминия Al2(SO4)3.18 H2O получается при действии горячей серной кислоты на оксид алюминия или на каолин. |
Раздел: Рефераты по химии Тип: реферат |
| Производство Алюминия | |
|
Одна весьма сомнительная легенда рассказывает, что однажды к римскому императору Тиберию (42 г. до н. э. - 37 г. н. э.) пришел человек с металлической ... Алюминий, растворяющийся из анодного слоя в электролите, выделяется над электролитом (верхний катодный слой). Первичный алюминий, извлекаемый из электролизеров (алюминий-сырец), содержит ряд примесей, которые можно подразделить на три группы: неметаллические (фтористые соли, ѭи ѭ-глинозем ... |
Раздел: Рефераты по металлургии Тип: реферат |