Реферат: Строение атома. Есть ли предел таблицы Менделеева?
Пермский государственный педагогический университет
Реферат по теме
Эволюция представлений
о строении атома.
Есть ли предел
системе элементов Менделеева?
Выполнил студент 141 группы
Попов Илья
Пермь 2002
ОГЛАВЛЕНИЕ
Возникновение атомистики. 3
Атомистика в послеаристотелевскую эпоху. 5
Дальнейшее развитие атомистики (XIX в.) 5
Периодический закон. Есть ли граница системы элементов Менделеева?. 6
Интерпретация периодического закона. 9
Aтом Резерфорда-Бора. 10
Модели atоma до бора. 10
Открытие атомного ядра. 11
Atom бора. 13
Возникновение квантовой механики (1925— 1930 гг) 16
Трудности теории бора. 16
Идеи де Бройля. 18
Открытие спина. 18
Список использованной литературы.. 19
Возникновение атомистики
Вопрос о строении окружающего мира всегда волновал человека. Начало современной науке о строении вещества было положено в античном мире, работами древнегреческих ученых разных школ – ионийской, элеатской, пифагорейской.
Идея первичной материи (праматерии) ионийцев была очень привлекательной и неоднократно в той или иной форме возрождалась в физике.
Пытливое мышление древних греков построило концепцию элементов, из которых построена Вселенная. Впервые эта концепция была выдвинута Эмпедоклом (около 490—430 гг. до н.э.). «Эмпедокл,—говорил греческий философ и историк науки Тео-Фраст, — предполагает четыре материальных элемента, а именно: огонь, воздух, воду и землю; эти элементы, будучи вечными, изменяются по числу и величине путем соединения и разделения. Существуют два начала, при помощи которых элементы приводятся в движение — Любовь и Вражда, ибо элементы должны подвергаться двоякому движению, а именно: то соединению путем Любви, то разделению путем Вражды».
Таким образом, все разнообразие вещей, по Эмпедоклу, обусловлено сочетанием четырех различных элементов, а причиной изменения в природе является действие притягательных и отталкивательных сил, которые у Эмпедокла носят названия—Любовь и Вражда.
Существенно, что Эмпедокл ясно утверждал всеобщее начало сохранения. Его элементы вечны и неразрушимы. «Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться». С этого принципа Эмпедокла и начинается история законов сохранения, играющих такую фундаментальную роль в современной физике.
С V в. до н.э. центр греческой науки сконцентрировался в Афинах. Здесь появились первые научные школы. Здесь учил математик Гиппократ, философ и физик Анаксагор (около 500—428 гг. до н. э.), создавший учение о «семенах» всех вещей и движущем начале «нус» (дух), сообщившем элементам материи вращательное движение, в результате которого образовалась Земля и все вещи.
Анаксагор был современником основателей атомистики Левкиппа и Демокрита (около 460-370 гг. до н.э.).
Демокрит написал множество произведений по различным отраслям науки: математике, физике, философии и др. Основные положения теории Демокрита воспроизводятся во многих современных книгах по физике и философии почти одними и теми же словами:
1. Из ничего не происходит ничего. Ничто существующее не может быть разрушено. Все изменения происходят благодаря соединению и разложению частей.
2. Ничто не совершается случайно, но все совершается по какому-нибудь основанию и с необходимостью.
3. Не существует ничего, кроме атомов и чистого пространства, все другое только воззрение.
4. Атомы бесконечны по числу и бесконечно разнообразны по форме. В вечном падении через бесконечное пространство большие, которые падают скорее, ударяются о меньшие; возникающие из этого боковые движения и вихри служат началом образования мира. Бесчисленные миры образуются и снова исчезают одни рядом с другими и одни после других.
5. Различие между вещами происходит от различия их атомов в числе, величине, форме и порядке; качественного различия между атомами не существует. В атоме нет никаких «внутренних состояний»; они действуют друг на друга только путем давления и удара.
6. Душа состоит из тонких, гладких и круглых атомов, подобных атомам огня. Эти атомы наиболее подвижны, и движения их, проникающие в тело, производят все жизненные явления.
Атомное учение, пройдя через века, выдержало ожесточенную борьбу с идеализмом и стало основой всего современного естествознания.
В учении атомистов играет существенную роль принцип сохранения, который, как мы видим, был уже у ионийцев. Новым моментом является допущение пустоты. Ни у ионийцев, ни у пифагорейцев, ни у элеа-тов пустоте нет места.
В системе Демокрита нет места для какого-то «разума», производящего движение частиц, движение атомов вечно и не нуждается в особом начале. Движущиеся в пустом бесконечном пространстве атомы, сталкиваясь друг с другом, производят все вещи и бесчисленные миры. Пустое бесконечное пространство Демокрита - это совершенно новый элемент картины мира, и его появление вызвано успехами геометрии.
Сам Демокрит был крупным математиком. В математических доказательствах Демокрита огромную роль играла атомистика. Атомами линии были точки, атомами поверхности — линии, атомами объемов—тонкие листки.
Успехи геометрии формировали представление о пустом пространстве, лишенном каких-либо чувственно осязаемых свойств. Линии, поверхности, геометрические тела становились абстрактными образами, чистой формой. Пространство, свойства которого в дальнейшем описал Евклид, является чистой протяженностью, лишенной материального содержания, и ареной движения атомов, вместилищем всех тел природы. Согласно учению атомистов бесконечно пустого пространства и атомов достаточно для описания разнообразных явлений мира, в том, числе социальных и психических. Учение атомистов—монистическое учение, по которому материя и движение—основы бытия.
К 431—404 гг. до н.э. наступил упадок Афин и афинской демократии. Происходили глубокие изменения в идеологии. Материалистическая система ионийцев и атомистов вытеснилась идеалистической философией Сократа (469—399 гг. до н.э.) и его ученика Платона (427—347 гг. до н.э.). Общество ощущало потребность в систематизированном научном знании, и на долю ученика Платона, знаменитого мыслителя древности Аристотеля выпала задача составить систематический свод научных знаний своего времени.
Научное наследие Аристотеля огромно. Оно образует полную энциклопедию научных знаний своего времени. Пожалуй, ни один ученый не оказывал такого длительного и глубокого влияния на развитие человеческой мысли, как Аристотель. Его воззрения принимались за истину в течение ряда столетий. В средневековых европейских университетах естествознание излагалось по Аристотелю, которого называли предтечей Христа в истолковании природы.
Он признавал объективное существование материального мира и его познаваемость. Но одновременно он верил в существование богов, противопоставлял земной и небесный миры, искал высшую цель природы и т. п.
Аристотель был крестным отцом науки о мире. Название его книги, посвященной исследованию природы («физика»), стало названием физической науки.
Существенным моментом в представлении Аристотеля о материи является то, что она сама по себе служит только возможностью возникновения реальной вещи, некоторым пассивным началом природы. Для того чтобы вещь стала реальностью, она должна получить форму, которая превращает возможность в действительность. Всякая вещь есть единство материи и формы, в природе происходят постоянные переходы материи в форму, формы в материю. Отсюда возникает учение Аристотеля о четырех действующих причинах: 1) материальной; 2) формальной; 3) производящей; 4) конечной. Активная производящая причина есть движение, конечная — цель.
Учение о четырех причинах получило большое распространение в средние века, став краеугольным камнем схоластики.
В своей «физике» Аристотель подробно разбирает взгляды своих предшественников — ионийцев, элеатов, Анаксагора, Левкиппа и Демокрита на первоначала мира. Он критикует воззрения атомистов, признающих пустоту и бесчисленное множество атомов и миров, так как, по его мнению, эта точка зрения приводит к логическим противоречиям. Бесконечное мыслимо только в возможности («потенциальная бесконечность»), реальный мир конечен и ограничен и построен из конечного числа элементов.
Понятие пустоты, по Аристотелю, также ведет к противоречиям с действительностью. Правильно подметив, что среда оказывает сопротивление движению и тем большее, чем она плотнее, Аристотель приходит к выводу, что бесконечное разреженное пустое пространство приводило бы к бесконечному движению. Это, по его мнению, невозможно. В отсутствие сопротивления скорость тела была бы бесконечной, что также невозможно. Любопытно, что другим аргументом против пустоты является совершенно правильный вывод Аристотеля об одинаковой скорости падения всех тел в пустоте, равно как и вывод о бесконечном инерциальном движении. В реальных условиях движение конечно и тела падают с разной скоростью. Аристотель полагает, что, чем тяжелее тело, тем быстрее оно падает.
Пустота, невесомость, по Аристотелю, неестественны, невозможны. Аристотелевский физик—это человек, живущий в воздушной среде на неподвижной Земле, в поле тяготения этой Земли и не мыслящий мир без этих атрибутов. В соответствии с повседневными представлениями Аристотель принимает геоцентрическую систему мира и концепцию ограниченной Вселенной, расслоенной на сферы движения небесных светил.
Естествознанию предстояло пройти длительный путь поисков и борьбы, чтобы прийти к иному миропониманию.
Атомистика в послеаристотелевскую эпоху
Войны Александра Македонского изменили лицо древнего мира и привели в соприкосновение греческую и восточную цивилизации. Из этого контакта возник сплав культуры, играющий большую роль в мировой истории.
В истории науки и культуры древнего мира начался новый период, получивший название эллинистического, продолжавшийся от образования эллинистических государств (конец IV—начало III в. до н.э.).
Последним блестящий представитель афинской науки был Эпикур (341—270 гг. до н. э.), развивший учение Демокрита о природе.
Учение Эпикура о природе основано на концепции атомов Демокрита, но несколько отличном. Значителен размах атомной теории. Существованием атомов Эпикур, а за ним и Лукреций пытаются объяснить все естественные, психические и социальные явления. Само представление об атомах выводится из хорошо известных фактов. Так, белье сохнет потому, что под действием солнца и ветра от него отрываются невидимые частицы воды, рука медной статуи у городских ворот, к которой прикасаются в поцелуе губы входящих в город, заметно тоньше по сравнению с другой рукой, так как при поцелуе губы уносят частицы меди.
Атомы находятся в беспорядочном движении, и Лукреций рисует модель движения атомов, уподобляя его движению пылинок в солнечном луче, ворвавшемся в темную комнату. Это первая в истории науки картина молекулярного движения, написанная древним автором. Само хаотическое движение атомов Эпикур объясняет иначе, чем Демокрит. Эпикур не признает различия в скорости падения малых и больших атомов; в пустом пространстве все частицы движутся с одинаковой скоростью. Но в некоторые моменты самопроизвольно возникают случайные небольшие отклонения той или иной частицы от прямолинейного пути. Эти отклонения Эпикур считал необходимыми, чтобы объяснить свободную волю людей, так что атомы как бы также обладают некоей «свободой воли».
Гениальные догадки древних атомистов предопределили будущий успех атомной теории материи.
Атомистика Эпикура — Лукреция продолжала линию научного развития доаристотелевского периода. Но атомистика послеаристотелевской эпохи носит и существенно новые черты: она более конкретна, более «физична», чем теория Аристотеля и атомистика Демокрита. Атомы Демокрита по существу чисто геометрические образы, они характеризуются только формой и объемом. У Эпикура и Лукреция атомы обладают весом, плотностью (твердостью) и, наконец, внутренней способностью к самопроизвольным отклонениям от прямолинейного движения.
Естествознание в эту эпоху стало переходить из сферы отвлеченного, философского размышления о природе в сферу конкретных фактов и явлений.
Евклид (жил в III в. до н.э.) подытожил и систематизировал математические знания своих предшественников, из коих его учителем был знаменитый ученый Евдокс Книдский. «Начала» Евклида представляют собой изложение той геометрии, которая известна и поныне под названием евклидовой геометрии.
Евклидово пространство пустое, безграничное, изотропное, имеющее три измерения. Евклид придал математическую определенность атомистической идее пустого пространства, в котором движутся атомы. Простейшим геометрическим объектом у Евклида является точка, которую он определяет как то, что не имеет частей. Другими словами, точка— это неделимый атом пространства.
Дальнейшее развитие атомистики ( XIX в.)
Всеобъемлемость принципов термодинамики, открытых и разработанных к этому времени и, в частности, второго начала, заставляла физиков-теоретиков искать причины универсальной мощи термодинамики.
В результате в науке возникли два направления: феноменологическое и атомистическое. Феноменологическое направление не считало необходимым искать более глубоких причин физических процессов, оно ограничивало задачу изучения природы описанием явлений на основе экспериментально установленных принципов. Энергетики Гельм, Оствальд и другие считали энергию основным понятием науки, а такие понятия, как «материя», «сила», производными и даже излишними.
Что касается представления об атомах и молекулах, то энергетики, а также венский физик Эрнст Мах, один из видных сторонников феноменологического направления, считали эти представления продуктами чистой фантазии, аналогичными представлениям о ведьмах и привидениях.
Однако такие видные представители науки, как Клаузиус, Максвелл, а затем Больцман, с успехом разрабатывали молекулярно-кинетическую теорию.
Максвелл, Клаузиус, Больцман, Гиббс, развивая физическую атомистику, искали законы, управляющие поведением коллектива атомов и молекул, делая по возможности простые гипотезы о строении самих атомов. В XIX в. единственным средством наблюдать взаимодействия атомов и определять их индивидуальные особенности были химические реакции. Именно в недрах химической атомистики родилась первая гипотеза о строении всех атомов из атомов водорода (Проут, 1815).
В 1859 г. было сделано важное открытие в оптике, физик Густав Кирхгос (1824-1887) и химик Роберт Бунзен (1811—1899) открыли спектральный анализ, давший в руки химикам новое мощное средство исследования.
Периодический закон. Есть ли граница системы элементов Менделеева?В 1869 г. уже было известно 63 химических элемента. В этом же году Д.И.Менделеев открыл фундаментальный закон распределения элементов в систему, которую он назвал периодической системой химических элементов.
До этого на протяжении более ста лет в научном мире господствовала картина мира, которую вполне выразил 1808 году своим трудом «Новая система химической философии» Джон Дальтон.
Уже было известно, что водород, кислород, сера и другие вещества – простые тела состоят из атомов одного сорта, а вода, аммиак, углекислый газ и др. – сложные, созданы комбинацией атомов разных веществ. Это вполне подтверждалось опытами того времени.
Химические реакции, по Дальтону, заключаются в том, что атомы вступают друг с другом в разные комбинации, образуя «сложные атомы» (молекулы), затем эти молекулы распадаются, образуются новые молекулы и т. д., подобно тому как танцоры, переходя от одного танца к другому; образуют новые комбинации. Но сами атомы при этом остаются неизменными и вечными: меняется только их распределение.
«Каждая частица воды,— говорит Дальтон в своей „Химической философии",— в точности похожа на любую другую частицу воды; каждая частица водорода в точности похожа на любую другую частицу водорода и т. д. Химическое разложение и химическое соединение означают лишь то, что атомы удаляются друг от друга или же снова сцепляются вместе. Но химик не способен уничтожить материю или создать ее вновь. Пытаться создать или уничтожить хотя бы один атом водорода так же безнадежно, как пытаться прибавить еще одну планету к Солнечной системе или уничтожить какую-нибудь из существующих планет. Все, что мы можем сделать,— это разъединить атомы, соединившиеся или сцепившиеся друг с другом, или же соединить те атомы, которые сейчас находятся на большом расстоянии друг от друга».
«Химическая философия», изложенная в этих строках Дальтона, действительно стала философией целого ряда поколений химиков и физиков. Невозможность создания хотя бы одного нового атома данного химического элемента, невозможность превращения одних атомов в другие — все это было необходимым выводом из всего огромного опытного материала, на котором основывалась научная химия.
В этом пункте Дальтон не совсем сходился с Бойлем, который в 1661 году писал, что хотя атомы остаются неизменными при всех химических явлениях, но тем не менее когда-нибудь будет найден некий «сильный и тонкий агент», с помощью которого удастся разбить атомы на более мелкие части и превратить одни атомы в другие.
Эта мысль Бойля казалась Дальтону чистой фантазией: ни один химический факт не указывал на то, что атомы возможно разбивать на части и превращать друг в друга.
В 1816 грду неожиданно нашелся один сторонник Бойля, пытавшийся подтвердить ее фактами. Это был Уильям Праут, который напечатал в журнале «Философские анналы» статью, где обращал особенное внимание на тот факт, что все атомные массы, которые определил Дальтон, выражаются целыми числами. Это — очень замечательный факт, говорил Праут, ведь если бы атомы всех химических элементов были первичными, основными частицами, подлинными «кирпичами мироздания», неразложимыми на частя и нисколько не связанными друг с другом, то какая могла бы быть причина того, что атом азота ровно в пять раз превосходит по массе атом водорода, а атом кислорода — ровно в семь раз?
Мнение Праута вот какое: атом азота, который, по Дальтону, ровно в пять раз превосходит по массе атом водорода,— это и есть пять атомов водорода, очень тесно сцепленных друг с другом; атом кислорода — это семь атомов водорода, тесно сцепленных друг с другом; атом ртути—это 167 тесно прижавшихся друг к другу водородных атомов и т. д. Выходит, что все на свете состоит в конечном счете из водорода.
А чем же объяснить, что все-таки в химических опытах никак не удается, например, разложить кислород на водород? Очень просто, отвечает Праут, все дело в том, что когда семь атомов водорода сцепляются, чтобы образовать атом кислорода, то они сцепляются гораздо теснее, чем тогда, когда, например, атом водорода и атом кислорода сцепляются, чтобы образовать молекулу воды. Поэтому-то в химических опытах и удается разложить молекулу воды на атом водорода и атом кислорода, но ни как не удается разложить атом кислорода на семь атомов водорода.
Статья Праута была очень убедительна,— многие поверили в то, что водород есть действительно «первичное вещество», из которого состоит все на свете. Одна только была беда — те химические анализы, основываясь на которых Дальтон вычислил свои атомные массы, были очень уж неточны. Если провести анализы тщательнее и вычислить атомные массы точнее, то окажутся ли они по-прежнему целыми числами?
За грандиозную работу точного определения атомных масс взялся знаменитый шведский химик Йене Якоб Берцелиус. Берцелиусу, больше чем кому-нибудь другому, химия обязана тем, что она стала точной наукой. В течение своей жизни Берцелиус проанализировал больше двух тысяч различных химических соединений, и результаты его анализов отличаются от самых точных теперешних результатов не больше чем на 1—2%.
Берцелиус стремился определить состав молекулы так, чтобы удовлетворительно объяснить возможно большее число химических фактов. Таким образом Берцелиус обнаружил, например, что молекула воды состоит не из двух атомов, а из трех — одного кислородного и двух водородных, что молекула аммиака состоит из четырех атомов — одного азотного и трех водородных, и т. д. Все это привело к тому, что хотя работы Берцелиуса и дали блестящее подтверждение основных идей Дальтона, но полученные Дальтоном конкретные цифры — атомные массы — оказались сплошь неверны.
Таким образом, гипотеза Праута, которая была основана на том, что атомные массы элементов — точные целые числа в то время не подтвердилась.
| Таблица химических элементов, их символов и атомных масс *) | ||||||
| № | Название и символ | Ат. масса | № | Название и символ | Ат. масса | |
| 1 | Водород Н | 1,008 | 37 | Рубидий Rb | 85,468 | |
| 2 | Гелий Не | 4,003 | 38 | Стронций Sr | 87,62 | |
| 3 | Литий Li | 6,941 | 39 | Иттрий Y | 88,906 | |
| 4 | Бериллий Be | 9,012 | 40 | Цирконий Zr | 91,22 | |
| 5 | Бор В | 10,811 | 41 | Ниобий Nb | 92,906 | |
| 6 | Углерод С | 12,011 | 42 | Молибден Мо | 95,94 | |
| 7 | Дзот N | 14,007 | 43 | Технеций Те | 98,906 | |
| 8 | Кислород 0 | 15,9994 | 44 | Рутений Ru | 101,07 | |
| 9 | Фтор F | 18,998 | 45 | Родий Rh | 102,905 | |
| 10 | Неон Ne | 20,179 | 46 | Палладий Pd | 106,4 | |
|
11 12 |
Натрий Na Магний Mg |
22,990 24,305 | 47 48 | Серебро Ag Кадмий Cd | 107,868 112,40 | |
| 13 | Алюминий AI | 26,981 | 49 | Индий In | 114,82 | |
| 14 | Кремний Si | 28,086 | 50 | Олово Sn | 118,69 | |
| 15 | Фосфор Р | 30,974 | 51 | Сурьма Sb | 121,75 | |
| 16 | Сера S | 32,06 | 52 | Теллур Те | 127,60 | |
| 17 | Хлор С1 | 35,453 | 53 | Йод I | 126,905 | |
| 18 | Аргон Аг | 39,948 | 54 | Ксенон Хе | 131,30 | |
| 19 | Калий К | 39,098 | 55 | Цезий Cs | 132,905 | |
| 20 | Кальций Са | 40,08 | 56 | Барий Ва | 137,33 | |
| 21 | Скандий Sc | 44,956 | 57 | Лантан La | 138,906 | |
| 22 | Титан Ti | 47,90 | 58 | Церий Се | 140,12 | |
| 23 | Ванадий V | 50,941 | 59 | Празеодим Рг | 140,908 | |
| 24 | Хром Сг | 51,996 | 60 | Неодим Nd | 144,24 | |
| 25 | Марганец Мп | 54,938 | 61 | Прометий Рш | 146 | |
| 26 | Железо Fe | 55,847 | 62 | Самарий Sm | 150,4 | |
| 27 | Кобальт Со | 58,933 | 63 | Европий Ей | 151,96 | |
| 28 | Никель^ Ni | 58,70 | 64 | Гадолиний Gd | 157,25 | |
| 29 | Медь Си | 63,546 | 65 | Тербий ТЬ | 158,925 | |
| 30 | Цинк Zn | 65,38 | 66 | Диспрозий Dy | 162,50 | |
| 31 | Галлий Ga | 69,72 | 67 | Гольмий Но | 164,930 | |
| 32 | Германий Ge | 72,59 | 68 | Эрбий Ег | 167,26 | |
| 33 | Мышьяк As | 74,922 | 69 | Туллий Тш | 168,934 | |
| 34 | Солен Se | 78,96 | 70 | Иттербий Yb | 173,04 | |
| 35 | Бром Вг | 79,904 | 71 | Лютеций Lu | 174,97 | |
| 36 | Криптон Кг | 83,80 | 72 | Гафний Hf | 178,49 | |
Заметим все же, что очень многие атомные массы, особенно в начале таблицы, весьма близки к целым числам, иногда в точности им равны, например, у фтора и углерода, а иногда отличаются от них меньше чем на 0,01, например, у водорода, гелия, азота, натрия и т. д. Это странное обстоятельство заставляет как будто отнестись с некоторым вниманием к гипотезе Праута, так как трудно себе представить, чтобы это могло быть результатом чистого случая, но тем не менее такие атомные массы, как у магния или хлора, не говоря уже о многочисленных элементах с большими атомными массами, все-таки принуждают отбросить предположение о том, что все атомы состоят из атомов водорода.
Поэтому в XIX столетии совершенно укрепилось и распространилось представление о том, что все тела в мире состоят из этих нескольких десятков сортов атомов которые являются совершенно независимыми друг от друга основными элементами мироздания. Атомы вечны и неразрушимы и не могут превращаться друг в друга.
И все же, несмотря на все это, среди физиков и химиков продолжало жить смутное убеждение в том что между атомами различных химических элементов имеются какие-то связи, что эти атомы образуют какую-то естественную систему.
В 1786 году немец Н. Г. Марне напечатал книгу, озаглавленную «О числе элементов». В этой книге мистической и странной, он выражает свое глубокое убеждение в том, что «от мельчайшей пылинки солнечного луча до святейшего серафима можно воздвигнуть целую лестницу творений» и что атомы химических элементов тоже являются ступенями этой лестницы.
Эта идея Марне не могла привести ни к каким последствиям, пока химические элементы не были в достаточной мере выделены и изучены. Но после того, как Каннипцаро опубликовал (в 1858 году) свою таблицу атомных масс, стремление к естественной классификации химических элементов должно было принести свои плоды.
В 1863 году англичанин Дж. А. Ньюлендс, воспользовавшись атомными массами Канниццаро, нашел, что если расположить элементы в порядке возрастания их атомных масс, то такой список элементов естественно разлагается на октавы, т. е. на строчки по семь элементов в каждой, где каждый элемент обладает большим сходством с одинаковым по номеру элементом предыдущей и последующей октав. Приведем первые три октавы Ньюлендса:
Н, Li, Be, В, С, N, О;
F, Na, Mg, Al, Si, P, S;
С1, К, Са, Сг, Ti, Mn, Fe.
Аналогия проявляется в том, что все элементы, стоящие на втором месте в своей октаве (литий, натрий, калий), являются так называемыми щелочными металлами, образующими соединения по одному и тому же типу, например дающими соли LiCI, NaCl, KC1; элементы, стоящие на третьем месте в октаве (бериллий, магний, кальций), являются так называемыми щелочноземельными металлами, дающими тоже похожие друг на друга, но уже иного типа соединения, например соли BeCl,MgCl, CaCl. Фтор весьма похож по своей химической природе на стоящий под ним хлор, азот обнаруживает некоторые аналогии с фосфором, кислород — с серой и т. д. Заметим, впрочем, что все получается так хорошо и убедительно лишь в первых октавах Ньюлендса: в дальнейших октавах было гораздо больше путаницы, и в некоторых случаях для ее устранения Ньюлендс позволил себе отступить от принятого им плана и располагать элементы не совсем в порядке возрастания атомной массы.
Через несколько лет после этой попытки Ньюлендса она была повторена двумя другими учеными, работавшими над вопросом естественной классификации элементов совершенно независимо друг or друга. Одним из них был Юлиус Мейер, другим—Дмитрий Иванович Менделеев, профессор университета в Санкт-Петербурге. И Мейер, и Менделеев сообразили, что могут существовать и элементы, еще не открытые химиками, а поэтому, если этого требует классификация, можно оставлять в таблице пропуски, соответствующие еще не открытым элементам.
Кроме того, они сочли схему Ньюлендса с ее одинаковыми строчками чрезмерно узкой и допустили, что строчки (периоды) могут становиться длиннее к концу таблицы.
Уже в четвертой строке таблицы классификация потребовала оставления пустых мест. На этих пустых местах должны находиться какие-то еще не открытые элементы. Три таких элемента Менделеев заочно точно описал и позже они были открыты.
Также нет ничего невозможного в существовании в природе элементов с атомной массой, большей урана. В наши дни такие «трансурановые» элементы были получены искусственно.
Вполне можно утверждать, что предела таблицы не существует и получение или нахождение других трансурановых элементов – это дело будущего.
Таково, в общих чертах, учение об атомах химических элементов, созданное Дальтоном и определившее все дальнейшее развитие химии в XIX столетии.
, с помощью которого в итоге был расшифрован периодический закон. Испускание а-частицы приводит к смещению радиоэлемента на два места влево в периодической системе (в направлении уменьшения массы). Но прохождение радиоактивных рядов через периодическую систему не прямолинейное, а зигзагообразное, так что превращающийся радиоэлемент часто возвращается назад—на то же место, которое занимал ранее в периодической системе его материнский продукт. Когда это происходит, то оказывается, что материнский радиоэлемент и его последующий продукт распада — изотоп (занимающий то же с, мое место в периодической системе) имеют одинаковые химические свойства, несмотря на различие в их атомных массах.
Интерпретация периодического закона
В 1911 г. был сформулирован закон радиоактивных смещений (периодический закон), который в его законченной формулировке оказался чрезвычайно простым и не допускающим никаких исключений. Он стал подлинным фундаментом. Согласно этому закону, испускание b-частицы ведет к смещению радиоэлемента на одно место вправо в периодической системе, а испускание а-частицы — к смещению радиоэлемента на два места в обратном направлении. Поскольку многие а-распады сопровождаются двумя последующими (b-распадами, то в таких случаях третий продукт распада всегда возвращается — на фоне периодической системы — на место исходного а-излучателя, являясь химически тождественным с ним, несмотря на разницу в четыре единицы в их атомных массах. В 1913 г. они были названы изотопами или изотопными элементами; этот термин означает, что они занимают одно и то же место в периодической системе. Изотопы двух разных элементов могут иметь одинаковую атомную массу, и тогда их называют изобарами. Реже изотопы одного и того же элемента могут иметь одинаковую атомную массу, но разную стабильность, т. е. один из них радиоактивен, а другой— нет.
Поскольку а-частица обладает зарядом в две положительные единицы, а заряд b-частицы равен единице со знаком минус, то сразу стало очевидным, что периодический закон отражает связь между химическими свойствами н внутриатомным зарядом, но не массой. В настоящее время периодический закон является in cxtcnto (повсюду) выражением, во-первых, атомной (дискретной) природы электричества и, во-вторых, нового вида атомистики.
Aтом Резерфорда-Бора
Модели atоma до бора
Но вернемся к последовательному изложению развития представлений о строении атома.
Развитие исследований радиоактивного излучения, с одной стороны, и квантовой теории — с другой, привели к созданию квантовой модели атома Резерфорда — Бора. Но созданию этой модели предшествовали попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 г. появились публикации о строении атома, принадлежащие одна японскому физику Хантаро Нагаока, другая— английскому физику Д. Томсону.
Нагаока исходил из исследований Максвелла об устойчивости колец Сатурна и представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по установленным кольцеобразным орбитам движутся «планеты»—электроны. При незначительных смещениях электроны возбуждают электромагнитные волны, периоды которых, по расчетам Нагаоки, того же порядка, что и частоты спектральных линий некоторых элементов.
В атоме Томсона положительное электричество «размазано» по сфере, в которую вкраплены, как изюм в пудинг, электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. При смещении из центра на электрон действует квазиупругая сила электростатического притяжения, под действием которой электрон совершает колебания. Частота этих колебаний определяется радиусом сферы, зарядом и массой электрона, и если радиус сферы имеет порядок радиуса атома, частота этих колебаний совпадает с частотой колебания спектральной линии атома. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял пытку теоретически объяснить периодическую систему элементов Д. И. Менделеева. Эту попытку Бор позднее назвал «знаменитой» и указал, что со времени этой попытки «идея о разделении электронов в атоме на группы сделалась исходным пунктом и более новых воззрений». Отметив, что теория Томсона оказалась несовместимой с опытными фактами, Бор тем не менее считал, что эта теория «содержит много оригинальных мыслей и оказала большое влияние на развитие атомной теории».
В 1905 г. В. Вин выступал с докладом об электронах на съезде немецких естествоиспытателей и врачей в Мюнхене. Здесь он, в частности, указывал на трудность объяснения линейчатых спектров атомов с точки зрения электронной теории. Он говорил: «Проще всего было бы понимать каждый атом как планетную систему, которая состоит из положительно заряженного центра, вокруг которого обращаются электроны как планеты. Но такая система не может быть устойчивой вследствие излучаемой электронами энергии. Поэтому мы вынуждены обратиться к системе, в которой электроны находятся в относительном покое или обладают ничтожными скоростями, хотя такое представление содержит много сомнительного».
Такой статической моделью был атом Кельвина — Томсона. И эта модель была общепринятой по причинам, указанным Вином.
В конце концов оказалось, что новые опытные факты опровергают модель Томсона и, наоборот, свидетельствуют в пользу планетарной модели, факты эти были открыты Резерфордом.
24 мая 1907 г. в Манчестере Резерфорд развернул огромную, привлекая молодых ученых из разных стран мира. Одним из его деятельных сотрудников был немецкий физик Ганс Гейгер, создатель первого счетчика элементарных частиц — счетчика Гейгера. В Манчестере с Резерфордом работали Э. Марсден, К. Фаянс, Г. Мозли, Г. Хевеши и другие физики и химики.
В Манчестер в 1912 г. приехал Нильс Бор.
В этой атмосфере коллективного научного творчества родились крупные научные достижения Резерфорда, из которых в первую очередь следует отметить разгадку природы а-частиц и открытие ядерного строение атома.
Сюда же следует присоединить знаменитые статьи Бора по квантовой теории планетарного атома. В Манчестере было положено начало квантовой и ядерной физике.
Открытие атомного ядра
Уподобление атома планетной системе делалось еще в самом начале XX в. Но эту модель было трудно совместить с законами электродинамики, и она была оставлена, уступив место модели Томсона. Однако в 1904 г. начались исследования, приведшие к утверждению планетарной модели.
Одна из тем, выдвинутая Резерфордом в Манчестере,—рассеяние а-частиц. Она была поручена Гейгеру и Марсдену.
Метод, применявшийся для исследования, заключался в следующем: а-частицы, испускаемые источником, диафрагмировались щелью попадали на экран из сернистого цинка. на котором получалось изображение щели в виде узкой полоски. Затем между щелью и экраном помещали тонкую металлическую пластинку, изображение щели размывалось, что указывало на рассеяние а-частиц веществом пластинки. Исследуя угол рассеяния, Гейгер установил, что наиболее вероятный угол рассеяния пропорционален атомному весу и обратно пропорционален кубу скорости частицы.
Но наиболее поразительным оказался факт, открытый Гейгером и Марсденом в 1909 г., — существование больших углов рассеяния. Некоторая, очень небольшая часть а-частиц (примерно 1/8000) рассеивается на угол, больший прямого, отбрасываясь, таким образом обратно к источнику. Тонкая пластине отбрасывала частицы, летящие с большой скоростью. Как раз в том же, 1909 году Резерфорд и Ройдс неопровержимо доказали, что а-частицы являются дважды ионизированными атомами гелия. Для таких тяжелых быстро движущихся частиц рассеивание на углы большие прямого, казалось весьма невероятным. Резерфорд говорил, что это так же невероятно, как если бы пуля отскакивала от листа папиросной бумаги.
Одно из возможных объяснений аномального рассеяния состояло в том что оно складывается из многих небольших углов отклонений, вызванные атомами рассеивающего вещества.
Исходя из модели Томсона, Резерфорд подсчитал, что это не может давать больших отклонений даже при многих столкновениях с частицей. И здесь Резерфорд обратился к планетарной модели.
Когда а-частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду а-частицы и обратно пропорциональной квадрату расстояния между ними, она движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее прямолинейный путь, таким образом, искривляется, и она отклоняется на угол рассеяния ф.
1 марта 1911 г. Резерфорд сделал в философском обществе в Манчестере доклад «Рассеяние а- и b-лучей и строение атома». В докладе он говорил: «Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома а- и b-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала».
Резерфорд рассчитал вероятность такого отклонения и показал, что она пропорциональна числу атомов п в единице рассеивающего материала, толщине рассеивающей пластинки и величине b2, выражаемой следующей формулой:
![]()
где Ne— заряд в центре атома, Е—заряд отклоняемой частицы, т—ее масса, и—ее скорость. Кроме того, эта вероятность зависит от угла рассеяния ф, так что число рассеянных частиц на единицу площади пропорционально cosec4 (Ф/2).
Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ± Ne. Заряд оказался пропорциональным атомному весу.
В 1913 г. Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеяние частиц по производимым ими сцинтилляционным вспышкам. Из этих исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.
В 1913 г. Ван ден Брук показал, что заряд ядра совпадает с номером элемента в таблице Менделеева. В том же1913 г. Ф. Содди и К. Фаянс пришли закону смещения Содди—Фаянса, ее гласно которому при а-распаде радиоактивный продукт смещается в менделеевской таблице на два номера выше а при b-распаде—на номер ниже. К этому же времени Содди пришел представлению об изотопах как разновидностях одного и того же элемент ядра атомов которых имеют одинаковый заряд, но разные массы.
В богатом событиям 1913 г. были опубликованы три знаменитые статьи Бора «О строении атомов и молекул», открывшие путь к атомной квантовой механике.
Томас Рис Вильсон (1869-1959) изобрел замечательный прибор, известный ныне под названием «камера Вильсона». Этот прибор позволяет видеть заряженную частицу по оставляемому ею туманному следу.
Позднее ученик и сотрудник Резерфорда Блэккет (1897—1974) получил вильсоновскую фотографию расщепления ядра азота а-частицей, первой ядерной реакции, открытой Резерфордом.
В этом же году Бор, имевший возможность поработать с автором первой модели атома, а затем с автором планетарной модели, на основе последней создает свою теорию атома Резерфорда-Бора.
Знаменитая статья Бора, в которой были заключены основы этой теории, начиналась с указания на модели Резерфорда и Томсона и обсуждения их особенностей и различий.
Резерфорд сразу понял революционный характер идей Бора и высказал критические замечания по самым фундаментальным пунктам теории Бора. После длительных дискуссий статья Бора и две его последующие статьи были опубликованы. Однако окончательный ответ на возражения Резерфорда был дан только созданием квантовой механики.
В 1915 г. Бор опубликовал работы «О сериальном спектре водорода и строении атома» и «Спектр водорода и гелия», «О квантовой теории излучения в структуре атома». Он развил исследования, выполненные им в Манчестере в августе 1912 г., и опубликовал их под названием «Теория торможения заряженных частиц при их прохождении через вещество».
В декабре 1915 и январе 1916 г. Арнольд Зоммерфельд (1868—1951) развил теорию Бора, рассмотрев движение электрона по эллиптическим орбитам и обобщив правила квантования Бора. Зоммерфельд дал также теорию тонкой структуры спектральных линий, введя релятивистское изменение массы со скоростью. В его расчеты вошла безразмерная универсальная постоянная тонкой структуры:
![]()
Теория атома после открытия Зоммерфельда стала называться теорией Бора — Зоммерфельда.
Продолжая развивать свои идеи, Бор сформулировал принцип соответствия (1918), означавший шаг вперед в ответе на вопросы, поставленные Резерфордом.
В 1922 г. Бор получил Нобелевскую премию по физике. В нобелевском докладе он развернул картину с стояния атомной теории к этому времени. Одним из наиболее существенных успехов теории было нахождения. ключа к периодической системе элементов, которая объяснялась наличие электронных оболочек, окружающих ядра атомов.
В 1925 г. работой Гейзенберга началось создание квантовой механики. В том же году Уленбек и Гаудсмит, работавшие у Эренфеста, открыли спин электрона, а Паули открыл принцип, носящий ныне его имя. После открытия Гейзенбергом в 1927 г. принципа неопределенности Бор выдвинул в качестве основной теоретической идеи квантовой теории принцип дополнительности.
В 1936 г. Бор выступил со статьей «Захват нейтрона и строение ядра», в которой предложил капельную модель ядра и механизм захвата нейтрона ядром. Ядерной физике была посвящена также работа 1937 г. «О превращении атомных ядер, вызванных столкновением с материальными частицами».
В конце 1938—начале 1939 г. было открыто деление урана.
Atom бора
Бор, как и Томсон до него, ищет такое расположение электронов в атоме, которое объяснило бы его физические и химические свойства. Бор уже знает о модели Резерфорда и берет ее за основу. Ему известно также, что заряд ядра и число электронов в нем, равное числу единиц заряда, определяется местом элемента в периодической системе элементов Менделеева. Таким образом, это важный шаг в понимании физико-химических свойств элемента. Но остаются непонятными две вещи: необычайная устойчивость атомов, несовместимая с представлением о движении электронов по замкнутым орбитам, и происхождение их спектров, состоящих из вполне определенных линий. Такая определенность спектра, его ярко выраженная химическая индивидуальность, очевидно, как-то связана со структурой атома.
Устойчивость атома в целом противоречит законам электродинамики, согласно которым электроны, совершая периодические движения, должны непрерывно излучать энергию и, теряя ее, «падать» на ядро. К тому же и характер движения электрона, объясняемый законами электродинамики, не может приводить к таким характерным линейчатым спектрам, которые наблюдаются на самом деле.
Линии спектра группируются в серии, они сгущаются в коротковолновом «хвосте» серии, частоты линий соответствующих серий подчинены странным арифметическим законам.
Так, Иоганн Бальмер в 1885 г. нашел, что четыре линии водорода На, Нb, Нg, Hs имеют длины волн, которые могут быть выведены из одной формулы:
![]()
Позже было найдено еще два десятка линий в ультрафиолетовой части, и их длины волн также укладывались в формулу Бальмера.
Иоганн Ридберг в 1889-1900 гг. нашел, что и линии спектров щелочных металлов могут быть распределены по сериям. Частоты линий каждой серии могут быть представлены в виде разности двух членов—термов. Так, для главной серии
![]()
где R — некоторое постоянное число, получившее название постоянной Ридберга, s и р — дробные поправки, меняющиеся от серии к серии.
«Основным результатом тщательного анализа видимой серии линейчатых спектров и их взаимоотношений, — писал Бор,—было установление того факта, что частота v каждой линии спектра данного элемента может быть представлена с необыкновенной точностью формулой v =T’—T”, где T' и T" — какие-то два члена из множества спектральных термов T, характеризующих элемент».
Бору удалось найти объяснение этого основного закона спектроскопии и вычислить постоянную Ридберга из таких фундаментальных величин, как заряд и масса электрона, скорость света и постоянная Планка. Но для этого ему пришлось ввести в физику атома представления о стационарных состояниях атомов, находясь в которых электрон не излучает, хотя и совершает периодическое движение по круговой орбите.
Для таких состояний момент импульса равен кратному от h/2p. При переходе с одной орбиты на другую электрон излучает и поглощает энергию, равную кванту. В заключительных замечаниях к трем своим статьям «О строении атомов и молекул» Бор формулирует свои основные гипотезы следующим образом:
«I. Испускание (или поглощение) энергии происходит не непрерывно, как это принимается в обычной электродинамике, а только при переходе системы из одного «стационарного» состояния в другое.
2. Динамическое равновесие системы в стационарных состояниях определяется обычными законами механики, тогда как для перехода системы между различными стационарными состояниями эти законы не действительны.
3. Испускаемое при переходе системы из одного стационарного состояния в другое излучение монохроматично, и соотношение между его частотой v и общим количеством излученной энергии Е дается равенством E=hv, где h — постоянная Планка.
4. Различные стационарные состояния простой системы, состоящей из вращающегося вокруг положительного ядра электрона, определяются из условия, что отношение между общей энергией, испущенной при образовании данной конфигурации, и числом оборотов электрона является целым кратным h/2p. Предположение о том, что орбита электрона круговая, равнозначно требованию, что момент им пульса вращающегося вокруг ядра электрона был бы целым кратным h/2p.
5. «Основное» состояние любой атомной системы, т. е. состояние, при котором излученная энергия максимальна, определяется из условия, чтобы момент импульса каждого электрона относительно центра его орбиты равнялся h/2p».
Далее Бор пишет: «Было показано, что при этих предположениях с помощью модели атома Резерфорда можно объяснить законы Бальмера и Ридберга, связывающие частоты различных линий в линейчатом спектре».
Именно Бор получил для спектра водорода формулу:
![]()
где t — целые числа.
«Мы видим,—пишет Бор,—что это соотношение объясняет закономерность, связывающую линии спектра водорода. Если взять t2 = 2 и варьировать t1, то получим обычную серию Бальмера. Если взять t2=3, получим в инфракрасной области серию, которую наблюдал Пашен и еще ранее предсказал Ритц. При t2=1и t2=4,5,... получим в крайней ультрафиолетовой и соответственной крайней инфракрасной областях серии, которые еще не наблюдались, но существование которых можно предположить ».
Действительно, серия в ультрафиолетовой области, соответствующая t2= 1, была найдена Лайманом в 1916 г., серия в инфракрасной области, соответствующая t2=4 была найдена Брэкетом в 1922 г., и серия t2=5 была найдена Пфундом в 1924 г.
Используя известные в то время значения е, т, h, Бор вычислил значение постоянной в спектральной' формуле:
![]()
тогда как экспериментальное значение равно 3,290*1015. «Соответствие между теоретическим и наблюдаемым значениями лежит в пределах ошибок измерений постоянных, входящих в теоретическую формулу», — писал Бор.
После опубликования статей Бора Фаулер обнаружил новые линии при разряде в трубке, заполненной водородом и гелием, которые, по его мнению, не укладываются в серию Бора. Бор уточнил теорию, введя движение ядра и электрона около общего центра массы. Тогда:
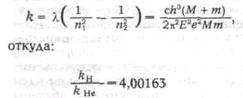
в точном соответствии с экспериментом.
В последующих работах Бор непрерывно уточнял основы своей теории. Она была дополнена принципом соответствия (1918), позволяющим делать определенные выводы об интенсивности и поляризации спектральных линий.
Сам Бор неоднократно занимался вопросом о влиянии магнитных и электрических полей на спектры атомов. Он же впервые включил в квантовую теорию атома и рассмотрение рентгеновских спектров, считая, что «характеристическое рентгеновское излучение испускается при возвращении системы в нормальное состояние, если каким-либо воздействием, например катодными лучами, были предварительно удалены электроны внутренних колец» (1913).
Генри Мозли в 1913—1914 гг. открыл закон смещения длин волн характеристических лучей, принадлежащих к одной и той же серии, при переходе от элемента к элементу. Частота рентгеновских лучей, определяющая их «жесткость», возрастает с возрастанием порядкового номера элемента.
Первое теоретическое истолкование рентгеновских спектров на основе идей Бора состоит в том, что они обязаны переходам электронов на вакантные места во внутренних оболочках. Оно было дано Зоммерфельдом в его фундаментальной работе 1916 г. В том же 1916 г. П. Дебай и П. Шеррер разработали новую методику рентгеновского анализа кристаллов в порошке, получившую широкое распространение в рентгеноструктурном анализе.
Идеи Бора получили экспериментальное подтверждение в опытах Джеймса Франка (1882—1964) и Густава Герца, которые начиная с 1913 г. изучали соударения электронов с атомами паров и газов. Оказалось, что электрон может сталкиваться с атомами газов упруго и неупруго. При упругом ударе электрон отскакивает от тяжелого атома (например, ртути), не теряя энергии, при неупругом ударе его энергия теряется и передается атому, который при этом либо возбуждается, либо ионизируется. Порции энергии, затрачиваемые на возбуждение атома, вполне определенные: так, электрон при столкновении с атомами ртути теряет энергию 4,9 эВ, что соответствует энергии кванта ультрафиолетового света длиной волны 2537 А.
Квантовый характер поглощения энергии атомом был продемонстрирован в опытах Франка, Герца и других физиков с поразительной наглядностью. За эти исследования, которые продолжались ряд лет, в 1925 г. Франк и Герц были удостоены Нобелевской премии.
Квантовый
характер излучения и поглощения энергии атомом лег в основу теоретического
исследования о световых квантах, выполненного Эйнштейном в 1916—1917 гг. В
этом исследовании Эйнштейн вывел формулу Планка, исходя из представления о направленном
излучении. Атом излучает и поглощает энергию квантами. Выстреливая квант в
определенном направлении, атом сообщает ему не только энергию hv , но и импульс ![]() .
.
При излучении молекула газа переходит из энергетического состояния Zm c энергией em в состояние Zn с энергией en излучая энергию em - en. Поглощая такую же энергию, молекула переходит из состояния Zn в состояние Zm. Молекула может перейти из состояния Zm в состояние Zn самопроизвольно, спонтанно. Вероятность такого перехода за время dt пропорциональна этому промежутку времени dt:
![]()
Но, кроме этого спонтанного перехода, впервые введенного Бором при объяснении спектров, по Эйнштейну, для молекул и атомов, находящихся в световом поле, возможны индуцированные переходы под действием светового излучения. Вероятность такого «индуцированного излучения»:
![]()
где p —объемная плотность световой энергии. Точно так же вероятность поглощения энергии молекулой, находящейся в состоянии Zn и перехода ее на высший энергетический уровень Zm будет:
![]()
В равновесном состоянии атом в среднем столько же поглощает энергии, сколько и излучает. Поэтому:
![]()
где по закону статистики Больцмана число молекул, находящихся в состоянии Zn, пропорционально:
![]()
Из предыдущего равенства получается:
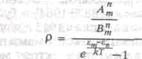
Положим ет — en =hv, для высоких частот, применяя закон Вина, получим формулу Планка:
![]()
Идея Эйнштейна об индуцированном излучении нашла в современной физике и технике важное применение в лазерах.
Как
было уже сказано, в 1916 г. Зоммерфельд обобщил теорию Бора, введя правила
квантования для систем с несколькими степенями свободы в виде ![]() .
.
Он рассмотрел движение по эллипсу, введя азимутальные и радиальные квантовые числа. Введя далее пространственное квантование и третье квантовое число, он дал теорию нормального эффекта Зеемана. Наконец, он дал теорию тонкой структуры спектральных линий и объяснение рентгеновских спектров. Все эти результаты были подробно разработаны им в классической монографии «Строение атомов и спектры», первое издание которой вышло в 1917 г. До 1924 г. включительно эта книга выдержала четыре издания. Последнее издание ее уже в двух томах вышло в 1951 г. и русский перевод— в 1956 г.
Таким образом, к 1917 г. идеи Бора получили всестороннее развитие как в работах самого Бора, так и других авторов. Они были экспериментально подтверждены, и теория Бора получила всеобщее признание. Но те трудные вопросы, которые были поставлены Резерфордом, еще не были сняты, а многие трудности, с которыми сталкивалась теория в попытках рассмотреть многоэлектронные атомы, аномальный эффект Зеемана и многое другое, показали, что в теории Бора при всех ее успехах есть серьезные недостатки принципиального характера. Трудности и противоречия накопились, и надо было искать выход.
Возникновение квантовой механики (1925— 1930 гг)
Трудности теории бора
Теория Бора с самого начала вызывала многие вопросы, остававшиеся без ответа. Эти вопросы были поставлены Резерфордом еще при обсуждении рукописи его первой статьи. Как понимать сочетание идей Бора и классической механики, в которой нет места для квантовых скачков, и откуда электрон знает, на какую орбиту ему следует перескакивать?
В 1896 г. голландский физик Питер Зееман (1865—1943) произвел опыт, который пытался осуществить еще Фарадей. Пламя натриевой горелки он помещал между полюсами электромагнита и наблюдал в спектроскоп ее спектр. По оси электромагнита был просверлен канал, так что явление можно было наблюдать не только перпендикулярно силовым линиям поля (поперечный эффект), но и вдоль поля (продольный эффект). При наблюдении поперек поля, кроме линии с частотой колебаний vo, равной частоте колебаний в отсутствие поля, наблюдались две линии с частотами v1=v0-Dv и v2=v0-Dv. Все три линии линейно поляризованы. Несмещенная линия соответствует колебаниям вдоль силовых линий, смещенные — колебаниям, перпендикулярным силовым линиям. При наблюдении вдоль поля несмещенная компонента отсутствует, смещенные линии поляризованы по кругу в противоположных направлениях.
Лоренц в 1897 г. дал простую теорию эффекта, исходя из представлений, что в атомах электроны совершают круговые движения с циклической частотой w0. В магнитном поле на них действует сила Лоренца и частота обращения изменяется на величину Dw, равную приближенно:
![]()
Лармор
(1857-1942) в 1899 г. интерпретировал действие магнитного поля как действие
поля тяжести на волчок. Волчок прецессирует вокруг направления силы тяжести с
угловой частотой Dw. Точно так же вращающиеся электроны в атоме
прецессируют вокруг силовых линий магнитного поля с круговой частотой ![]() .
.
Зоммерфельд, развивая теорию Бора, ввел идею пространственного квантования. Движение электрона по орбите определяется радиальным и азимутальным квантовыми числами или главным квантовым числом п, определяющим энергию электрона, и побочным квантовым числом k, определяющим форму орбиты. Положение орбиты в пространстве определяется третьим магнитным квантовым числом т. Введение этого числа и квантование направлений оси по отношению к магнитному полю позволяет дать объяснение эффекта Зеемана. Однако это объяснение в известном смысле было хуже объяснения, данного Лоренцем. Оно ничего не говорило о поляризации линий. Вообще теория спектров, по Бору и Зоммерфельду, говорила лишь о частотах линий и не могла объяснить их интенсивность и поляризацию. Чтобы теория могла что-то сказать об этом, Бор ввел принцип соответствия.
Согласно этому принципу «существует далеко идущее соответствие» между квантовым и классическим описанием излучения. В квантовом описании линии спектра излучения обусловлены переходами из одного состояния в другое, в классическом эти линии определяются разложением движения электрона в ряд Фурье. При этом, как указывает Н. Бор, «частота излучения, испускаемого при переходе между стационарными состояниями, характеризуемыми числами п' и п", большим по сравнению с их разностью, совпадает с частотой одной из компонент излучения, которую можно ожидать при избранном движении электрона в стационарном состоянии на основании обычных представлений. Далее Бор пишет: «Задаваясь вопросом о более глубоком значении найденного соответствия, мы вправе, естественно, ожидать, что соответствие не ограничивается совпадением частот спектральных линий, вычисленных тем и другим методом, но простирается и на их интенсивности. Такое ожидание равносильно тому, что вероятность определенного перехода между двумя стационарными состояниями связана известным образом с амплитудой, соответствующей гармонической компоненте».
Применение принципа соответствия позволило определить и поляризацию в нормальном эффекте Зеемана. Квантовый переход, соответствующий изменению магнитного квантового числа на ± 1, дает круговую поляризацию в плоскости, перпендикулярной к силовым линиям. Квантовый переход Am = 0 соответствует линейной поляризации, параллельной силовым линиям.
Но нормальный эффект Зеемана представляет скорее исключение, чем норму. На опыте встречается более сложный эффект: расчленение на несколько компонентов (мультиплетов). Мультиплетами оказываются и линии спектров элементов. Аномальный эффект и мультиплетная структура спектров не укладывались в рамки обычной теории Бора.
С вопросом о сложной структуре линий был тесно связан вопрос о магнитных свойствах атома. Еще Д. С. Рождественский в своем докладе 15 декабря 1919 г. предполагал, что дублеты п триплеты спектральных линий обусловлены действием магнитных сил, вы званных движением электронов. «Магнитная задача должна лежать в основе задачи об атомах»,—говорил Рождественский.
![]()
О.Штерн (1888-1969) и В. Герлах (род. в 1889 г.) в 1921 г. пропустили молекулярный пучок через неоднородное магнитное поле и неопровержимо доказали наличие у атомов магнитного момента. Но детали опыта (расщепление пучка на два) опять не укладывались в теорию Бора — Зоммерфельда.
В том же, 1921 г. А.Ланде (1888-1975) дал формальную схему описания мультиплетов с помощью векторной модели и ввел связанный с квантовыми числами k и s множитель Ланде. Он также получил «двойной магнетизм»: отношение между магнитным и вращательным моментом атомного остова (т.е. ядра и всех электронов, кроме оптического) оказалось вдвое больше того, который следует из теории Бора — Зоммерфельда. Противоречия с теорией Бора в ее первоначальном варианте накапливались на каждом шагу, и квантовое описание спектроскопических фактов все более и более усложнялось.
Особенно тягостное положение создалось в теории света. Эйнштейн в своей классической работе 1917 г. о световых квантах сделал дальнейший шаг в сторону корпускулярной теории света. Он предположил, что атом излучает, «выстреливая» квант света в том или ином направлении (игольчатое излучение). При этом квант света обладает всеми свойствами материальной частицы: энергией Е = hv, массой m.
Эта идея нашла блестящее подтверждение в открытии, сделанном американским физиком Артуром Комптоном. В 1922 г. Комптон, изучая рассеяние рентгеновских лучей веществом, содержащим слабо связанные электроны (графитом), установил, что частота (длина волны) рассеянных рентгеновских лучей изменяется в зависимости от угла рассеяния. С увеличением угла рассеяния она уменьшается (длина волны увеличивается), излучение становится более «мягким».
В 1923 г. А. Комптон и независимо от него П.Дебай дали теорию «эффекта Комптона». Теория была основана на идее Эйнштейна: квант света сталкивается с электроном по закону упругого удара. Применяя законы сохранения энергии и импульса, Комптон и Дебай получили формулу для изменения длины волны рассеянного излучения:
![]()
Дебай написал эту формулу в несколько измененном виде. Это простое и наглядное объяснение эффекта в сильной степени способствовало укреплению представления о кванте света как частице, для которой Комптоном был предложен термин «фотон», ставший общеупотребительным.
К 1924 г. в науке о свете создалось тягостное положение, которое очень наглядно охарактеризовал О. Д. Хвольсон. Разделив мелом доску на две части Л и В, он вписал на одной стороне факты, объясняемые волновой теорией света, на другой— факты, объясняемые квантовой теорией. «Ни волновая, ни квантовая теории,—говорил в связи с этим принимавший участие в съезде Эренфест,—не в состоянии охватить все области световых явлений». Всеобъемлющей теории света, как это констатировал Хвольсон, не было.
В поисках выхода из тяжелого положения авторы предложили даже отказаться от требования применения закона сохранения энергии к отдельным актам излучения и поглощения света атомом. Однако гипотеза Бора, Крамерса и Слэтера была опровергнута экспериментами, в которых доказывалось, что каждый акт взаимодействия света с веществом подчиняется закону сохранения энергии.
Идеи де Бройля
В 1923 г. в докладах Парижской Академии наук были опубликованы три статьи французского физика Луи де Бройля: «Волны и кванты», «Кванты света, дифракция и интерференция». «Кванты, кинетическая теория газов и принцип ферма», в которых выдвигалась совершенно новая идея, переносящая дуализм в теории света на сами частицы материи.
Де Бройль рассматривает некоторый волновой процесс, связанный с телом. движущимся со скоростью v = bс. Эта волна обладает частотой, определяемой соотношением E= hv = mc2, и движется в направлении движения тела со скоростью u=cb.
«Мы будем рассматривать ее лишь как фиктивную волну, связанную с перемещением движущегося тела». Де Бройль показывает далее, что для электрона, движущегося по замкнутой траектории с постоянной скоростью, меньшей скорости света, траектория будет устойчива, если на ней укладывается целое число таких волн. Условие это совпадает с квантовым условием Бора. Скорость частицы v = ре является скоростью группы волн, обладающих частотами, мало отличающимися друг от друга и соответствующими частоте — Эта волна, которую де Бройль называл «волной фазы», пилотирует движение частицы, несущей энергию те2, сама же фазовая волна энергии не несет. Гипотеза де Бройля позволяет «осуществить синтез волнового движения и квантов». Де Бройль утверждает наличие в природе волновых явлений и для частиц вещества. Он пишет: «Дифракционные явления обнаруживаются в потоке электронов, проходящих сквозь достаточно малые отверстия. Быть может, экспериментальное подтверждение наших идей следует искать в этом направлении ».
Де Бройль указывает, что его новая механика относится к прежней механике, классической и релятивистской, «так же как волновая оптика относится к геометрической». Он пишет, что предложенный им синтез «представляется логическим венцом совместного развития динамики и оптики со времени XVII в.».
Открытие спина
В 1925 г. в физику было введено новое фундаментальное понятие спина. Это понятие было введено Уленбеком и Гаудсмитом, работавшими летом 1925 г. у Эренфеста в Лейдене. К этому времени В. Паули опубликовал свою работу, содержащую формулировку принципа запрета, носящего его имя. Паули показал, что квантовое состояние электрона характеризуется четырьмя (а не тремя) квантовыми числами и что в этом состоянии может быть только один электрон. Статья Паули, содержащая формулировку его принципа, была опубликована весной 1925 г. Еще ранее Паули указал, что для характеристики состояния электрона необходимо четыре квантовых числа: главное кван товое число п, азимутальное квантовое число I и два магнитных числа т, и nif. Гаудсмит рассказал Уленбеку об этой работе Паули. Узнав это, Уленбек высказал такую мысль, что электрон обладает еще одной степенью свободы, которая соответствует вращению электрона (спину).
«После его замечания о спине,— писал Гаудсмит,—мы сразу увидели, что полностью выясняется, почему т, всегда равно +1/2 или —1/2. Далее мы увидели, что все случаи расщепления Зеемана могут быть объяснены, если приписать электрону магнитный момент, равный одному целому магнетону Бора. Кроме того, стало ясно, что спин находится в полном соответствии с нашим новым толкованием спектра водорода».
Эренфест немедленно отправил статью Уленбека и Гаудсмита в «Die Naturwissenschaften». Она появилась в 13-м номере журнала за 1925 г. Уленбек после консультации с Лоренцем выяснил, что скорость вращения электрона на экваторе для требуемого гипотезой момента должна быть больше скорости света, и потребовал возвращения статьи, но было уже поздно.
Паули очень неодобрительно встретил статью Уленбека и Гаудсмита. Еще ранее он отнесся отрицательно к аналогичной идее, высказанной Кронигом.
Бор и Гейзенберг, наоборот, проявили большой интерес к новой гипотезе, а после того как Томас вычислил на основе гипотезы спина значение дублетного расщепления, Паули снял свои возражения.
Таким образом, 1925 г. оказался годом рождения квантовой механики Гейзенберга и Дирака, годом рождения новой квантовой статистики Бозе— Эйнштейна, годом рождения принципа Паули и гипотезы спина.
Список использованной литературы1. П.С. Кудрявцев. «Курс истории физики» М.1982.
2. М.П. Бронштейн. «Атомы и электроны» М. 1980.
3. Г. Липсон. «Великие эксперименты в физике». М. 1972.
4. Ф. Содди. «История атомной энергетики». М. 1979.
5. К. Маколов. «Биография атома». М.1984.
| Философия и методология науки | |
|
Национальный Университет Узбекистана имени М. Улугбека Философский факультет Институт философии и права АН РУз. Учебно методический центр. Философия и ... Датский физик Нильс Бор (1885-1962), исходя из модели Резерфорда и модифицируя ее, введя постулаты (постулаты Бора), утверждающие, что в атомах имеются стационарные орбиты, при ... Так, периодический закон химических элементов противоречил господствовавшим в химии идеям классической механики и соответствующему логико-математическому аппарату с ней ... |
Раздел: Рефераты по философии Тип: учебное пособие |
| Основные концепции физики ХХ века | |
|
Революция в физике Физика XIX века представляла собой основанную на механике Ньютона систему знаний, которая создателям этой системы представлялась ... Появление и развитие таких разделов физики, как квантовая механика, квантовая электродинамика, общая теория относительности, теория строения атомов, физика атомного ядра и ... Термин "элементарные частицы" сейчас употребляется в менее строгом значении, а именно для названия большой группы мельчайших частиц материи, которые не являются атомами или ... |
Раздел: Рефераты по математике Тип: курсовая работа |
| Российские нобелевские лауреаты | |
|
Министерство образования РФ Курский государственный технический университет Реферат на тему "Российские Нобелевские Лауреаты" Выполнил: ст-т гр.БМ-91 ... Основной принцип квантовой физики состоит в том, что атомы и молекулы обладают энергиями (возникающими вследствие расположения и движения их электронов), ограниченными некоторыми ... По его настоянию и с помощью его коллег, заинтересованных в развитии физической химии, лаборатория физики электрона превратилась в 1931 г. в Институт химической физики Академии ... |
Раздел: Исторические личности Тип: реферат |
| Концепции макромира классической физики и концепции микромира ... | |
|
Маммедов А.Б., Баширов Р.И., Бакинский Государственный Университет, Азербайджан. Классические физические концепции о структуре и закономерностях ... В 1913 году датский ученый Нильс Бор, применяя принцип квантитативности к решению проблем строения атома и характеристики спектра атома, устранил противоречия в созданной ... Модель атома, предложенная Бором, не смотря на то, что дала точное описание атома водорода, состоящего из одного протона и одного электрона, и это описание довольно хорошо ... |
Раздел: Биология и химия Тип: статья |
| Развитие Физики во второй половине ХХ в. | |
|
Санкт-Петербургский Государственный Морской Технический Университет. Кафедра Истории. Реферат по истории Студент гр.31ПТ1 Поздняков А.В. Санкт ... Характерная особенность современной физики заключается в том, что наряду с классическими бурно развиваются и внедряются квантовые представления, на основании которых объясняются ... Атомная физика, являющаяся одним из разделов квантовой механики, изучает строение и состояние атомов. |
Раздел: Рефераты по физике Тип: реферат |